|
|
||||||||||||||||||||||||||||||||||||||||||||
|
|
AZUL DE METILENO UTILIDAD CLINICA EN EL TRATAMIENTO Y PREVENCION DE LAS COMPLICACIONES DE COVID 19 Abril 2021 Od. Marcelo Iruretagoyena. Wilde. Argentina.
Hipótesis med . 2021 Jan; 146: 110455. Publicado en línea el 10 de diciembre de 2020 doi: 10.1016 / j.mehy.2020.110455 PMCID: PMC7728423 PMID: 33341032 Giulio Scigliano a, ⁎ y Giuseppe Augusto Scigliano b, 1 Información del autor Notas del artículo Información sobre derechos de autor y licencia Renuncia de responsabilidad
Resumen
Antecedentes El SARS ‐ CoV ‐ 2 ingresa al huésped humano principalmente a través del tracto respiratorio, aunque también podría ocurrir transmisión fecal [1] . En algunos casos, la infección evoluciona hacia el síndrome de dificultad respiratoria aguda (SDRA) [2] , una forma de insuficiencia respiratoria que se desarrolla rápidamente en pacientes críticamente enfermos [3] . El SDRA se asocia a menudo con daño multiorgánico (principalmente pulmón, corazón, cerebro, riñón, hígado e intestino delgado) y choque séptico o vasoplejico [4] . Los pulmones se ven afectados temprano, ya que son las primeras estructuras que encuentra el virus después de la entrada a través del tracto respiratorio, y porque las células epiteliales alveolares expresan abundantemente los receptores ACE2 que el virus usa para ingresar a las células [5].. La lesión alveolar generalizada se acompaña de un daño severo en el endotelio vascular [6] que permite que el virus ingrese al torrente sanguíneo. Se han encontrado viremia y títulos altos de ARN viral en hígado, riñón y corazón en pacientes que murieron de Covid-19 [7] . No está claro si la barrera hematoencefálica puede prevenir el acceso viral al sistema nervioso central. Sin embargo, las células endoteliales capilares, constituyente fundamental de la barrera hematoencefálica, expresan abundantes receptores ACE2 y bien podrían ser una ruta de entrada al SNC. La invasión viral directa del cerebro a través de las vías olfativas también es una posibilidad [8] . Los receptores ACE2 están presentes en las células endoteliales vasculares de todos los órganos [9] , lo que explicaría la inflamación endotelial a través de los lechos vasculares de diferentes órganos informada en una serie de casos autópticos de Covid-19 [10] . Después de entrar en las células, el virus desencadena una reacción inflamatoria activando las vías de transducción de señales, incluido el factor de transcripción NF-kB, que estimula la producción de citocinas para contrarrestar la replicación y propagación viral [11] . Lo que no funcionó La evolución a SDRA y falla multiorgánica ocurre, en promedio, siete días después del inicio de los síntomas, cuando la carga viral ha disminuido significativamente [12] , [13] y se correlaciona con una reacción inflamatoria sistémica violenta, acompañada de una tormenta de citocinas. - más de lo necesario para eliminar el virus. Los medicamentos antivirales, asumiendo que funcionan contra Covid-19, solo tienen probabilidades de ser efectivos contra el ARDS / falla multiorgánica si se administran temprano, al inicio de los síntomas, antes de que haya comenzado la reacción inflamatoria. Por lo tanto, deben administrarse a todos los pacientes infectados, a un costo de varios miles de dólares por paciente. Se han probado fármacos anticitocinas, pero los resultados han sido decepcionantes, probablemente por dos razones principales: primero, estos fármacos inhiben sólo una o unas pocas de las cincuenta o más citocinas implicadas; en segundo lugar, hay otros protagonistas en el complicado escenario inflamatorio, incluidos los radicales libres (especies reactivas de oxígeno y nitrógeno, ROS y RNS), que no se han tenido en cuenta [14] , [15] . También se ha subestimado el papel de las cininas en el SDRA por Covid-19. Hay pruebas sólidas que apoyan el papel de la bradikinina, la histamina y la serotonina como mediadores clave de la inflamación pulmonar aguda y la dificultad respiratoria [16] . Radicales libres Los radicales libres se producen durante reacciones redox intracelulares en mitocondrias, peroxisomas y retículo endoplásmico, y están involucrados en muchas funciones fisiológicas, incluida la transducción de señales, la expresión génica y la apoptosis. Las células bronquiales, alveolares y endoteliales también producen abundantes radicales libres (ROS y RNS) para matar patógenos pero que también pueden dañar proteínas endógenas, lípidos y ácidos nucleicos. Los fagocitos activados (neutrófilos, monocitos y macrófagos) son reclutados en sitios de inflamación donde se adhieren al endotelio y también liberan una variedad de ROS para contribuir a la destrucción de patógenos y daño de órganos. La respuesta inflamatoria, inicialmente local y luego sistémica, es impulsada por ROS [17]cuya producción aumenta después de una infección viral para activar NF-kB y otros factores de transcripción que controlan los genes relacionados con la inflamación. NF-kB se mueve desde el citoplasma al núcleo y se une al ADN para desencadenar la síntesis de citocinas [17] , [18] . El papel de las ROS en la inducción de la síntesis de citoquinas ha sido destacado en modelos experimentales de inflamación sistémica [19] , [20] . En condiciones fisiológicas, el anión superóxido (progenitor de ROS) se inactiva rápidamente por la superóxido dismutasa. Sin embargo, después de estímulos inflamatorios o sépticos específicos, la producción de superóxido supera la capacidad de eliminación de la superóxido dismutasa y experimenta reacciones que conducen a ROS más reactivos, como el radical hidroxilo [21].. El óxido nítrico (progenitor del RNS) también se forma en exceso en respuesta a estímulos inflamatorios / sépticos [22] y reacciona con el anión superóxido para formar peroxinitrito, que es altamente tóxico. Todas estas especies reactivas dañan las membranas celulares y el ADN y pueden provocar la muerte celular [23] . Mínimo común denominador: daño endotelial El endotelio pulmonar y vascular son los más afectados en el Covid-19 grave, cuyas células son ricas en los receptores ACE2 utilizados por el virus para efectuar la entrada celular. Cuando la producción de ROS, RNS y citoquinas excede la capacidad de los tejidos para neutralizarlos, invaden el espacio intersticial e inducen estrés oxidativo, necrosis o apoptosis causando, y dañando los alvéolos pulmonares y el endotelio vascular [10] , [24] . Las citocinas, ROS y RNS también pueden extenderse a la circulación sistémica y causar daño endotelial en órganos distantes [25] , [26] . Por tanto, el endotelio de órganos distantes es el objetivo tanto de los virus circulantes como de los mediadores de la inflamación sistémica y, al mismo tiempo, es la fuente de los mediadores inflamatorios. Varias líneas de evidencia sugieren que el daño endotelial vascular y la trombofilia subsiguiente [27] son los factores centrales en la insuficiencia multiorgánica relacionada con Covid. Por ejemplo, la endotelialitis y la trombosis se han identificado como la causa de lesiones cutáneas en forma de sabañones en pacientes pediátricos con Covid-19 [28] . Además, se ha observado afectación histológica del sistema digestivo en un número limitado de casos de Covid autóptico; y en un caso autóptico se observó necrosis isquémica por trombosis reciente e infiltración inflamatoria grave del endotelio del vaso mesentérico [29] . Además, se encontró una alta incidencia de eventos tromboembólicos en las venas profundas de las extremidades inferiores en otra serie de casos de Covid autóptico [7].. En los pacientes con Covid-19 se observan con frecuencia complicaciones cardiovasculares como miocarditis, pericarditis, vasculitis e insuficiencia cardíaca. Sin embargo, el SARS-CoV-2 no siempre se ha aislado del miocardio de pacientes que han fallecido por Covid-19, lo que sugiere que el daño miocárdico se debe a una microcirculación alterada causada por una disfunción endotelial y una reacción hiperinflamatoria [30] . También es digno de mención que se han notificado casos de Covid con trastornos neurológicos causados por accidente cerebrovascular isquémico, hemorragia y microhemorragias difusas, lo que sugiere una microangiopatía secundaria [31] . La rotura endotelial de microvasos cerebrales con hemorragia en el parénquima cerebral puede tener graves consecuencias. Los glóbulos rojos derramados en el cerebro liberan hierro, que reacciona con el peróxido de hidrógeno endógeno para producir el radical hidroxilo altamente reactivo [32] . La persistencia del hierro perpetúa la producción de radicales hidroxilo, Que podria funcionar Por lo tanto, los radicales y las citocinas están íntimamente involucrados en la génesis del daño endotelial, que es el denominador común de la falla multiorgánica en Covid-19. Cuando ocurre el SDRA, la producción de ROS, RNS y citocinas está fuera de control, y el intento de contrastar todos con un solo inhibidor de citocinas está condenado al fracaso. Hasta donde sabemos, solo un fármaco es capaz de inhibir la producción de estas tres clases de sustancias: el azul de metileno. El azul de metileno inhibe la formación del anión superóxido (precursor de ROS) al bloquear la vía de la xantina oxidasa [33] ; contrarresta la síntesis de óxido nítrico (precursor de RNS) mediante la inhibición directa de la NO-sintasa [34] e inhibe la expresión de citocinas mediante la atenuación de la señalización de NF-kB [35] , [36]. El azul de metileno es una fenotiazina tricíclica, aprobada por la FDA y la EMA para el tratamiento de la metahemoglobinemia y la malaria. También se utiliza para inactivar virus en hemoderivados para transfusión, en presencia de luz ultravioleta. Estudios in vitro recientes (no revisados por pares) indican que tiene actividad antiviral en ausencia de luz ultravioleta [37] , [38] , lo que refuerza la justificación de su uso en Covid-19. Sin embargo, el uso de azul de metileno en pacientes con deficiencia de glucosa-6-fosfato deshidrogenasa está contraindicado debido al aumento del riesgo de anemia hemolítica [39].. También está contraindicado su uso concomitante con inhibidores de la recaptación de serotonina. El azul de metileno es un potente inhibidor reversible de la monoamino oxidasa A, la enzima que cataliza la degradación de la serotonina, y el uso concomitante con inhibidores de la recaptación de serotonina puede inhibir la degradación de la serotonina y aumentar su concentración a niveles tóxicos (síndrome de la serotonina) [40] . El azul de metileno, administrado por vía intravenosa en dosis que no superan los 2-3 mg / kg, se ha utilizado con éxito y de forma segura contra el choque séptico [41] , [42] , también en pacientes pediátricos [43] . El azul de metileno también se puede administrar por vía intravenosa en pacientes con Covid-19 gravemente afectados. Los estudios realizados en pequeños grupos de pacientes críticamente enfermos parecen demostrar la eficacia del azul de metileno combinado con otros antioxidantes [44] . “Sin embargo, dado que es imposible revertir la destrucción de tejido que ya se ha desarrollado, es importante comenzar el tratamiento temprano. Sugerimos iniciar el tratamiento oral con azul de metileno en los primeros síntomas de Covid-19 con el objetivo de prevenir la reacción inflamatoria excesiva. La dosis oral diaria habitual es de 200 mg.[45] , aunque se solían administrar 300 a 1000 mg / día en dosis orales divididas durante 7 a 23 días a los casos de malaria [46] . Sugerimos probar el azul de metileno oral a 2-3 mg / kg de peso corporal / día dividido en tres dosis diarias durante siete a diez días en pacientes recién infectados con SARS-CoV-2. Sin embargo, la dosis óptima también debe ser objeto de un estudio clínico. Declaración de intereses en competencia Los autores declaran que no tienen intereses económicos en competencia o relaciones personales que pudieran haber influido en el trabajo informado en este documento. Reconocimiento Los autores agradecen a Don Ward por su ayuda con el inglés. Declaración de financiación Esta investigación no recibió ninguna subvención específica de ninguna agencia de financiación en los sectores público, comercial o sin fines de lucro. Referencias 1. Amirian ES Posible transmisión fecal del SARS-CoV-2: Evidencia actual e implicaciones para la salud pública. Int J Enfermedades Infecciosas. 2020; 95 : 363–370. doi: 10.1016 / j.ijid.2020.04.057. [ Artículo gratuito de PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ] 2. Hu Y., Sun J., Dai Z., Deng H., Li X., Huang Qi, Wu Y., Sun Li, Xu Y. Prevalencia y gravedad de la enfermedad por coronavirus 2019 (COVID-19): A revisión sistemática y metaanálisis. J Clin Virol. 2020; 127 : 104371. doi: 10.1016 / j.jcv.2020.104371. [ Artículo gratuito de PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ] 3. Matthay MA, Zemans RL, Zimmerman GA, Arabi YM, Beitler JR, Mercat A., Herridge M., Randolph AG, Calfee CS Síndrome de dificultad respiratoria aguda. Primers Nat Rev Dis. 2019; 5 (1) doi: 10.1038 / s41572-019-0069-0. [ Artículo gratuito de PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ] 4. Zaim S., Chong JH, Sankaranarayanan V., Harky A. COVID-19 y Multiorgan Response. Curr Probl Cardiol. 2020; 45 (8): 100618. doi: 10.1016 / j.cpcardiol.2020.100618. [ Artículo gratuito de PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ] 5. Perrotta F., Matera MG, Cazzola M., Bianco A. Infección respiratoria grave por SARS-CoV2: ¿Importa el receptor ACE2? Respir Med. 2020; 168 : 105996. doi: 10.1016 / j.rmed.2020.105996. [ Artículo gratuito de PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ] 6. Ackermann M., Verleden SE, Kuehnel M., Haverich A., Welte T., Laenger F., Vanstapel A., Werlein C., Stark H., Tzankov A., Li WW, Li VW, Mentzer SJ, Jonigk D. Endotelialitis vascular pulmonar, trombosis y angiogénesis en Covid-19. N Engl J Med. 2020; 383 (2): 120-128. doi: 10.1056 / NEJMoa2015432. [ Artículo gratuito de PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ] 7. Wichmann D., Sperhake J.-P., Lütgehetmann M., Steurer S., Edler C., Heinemann A., Heinrich F., Mushumba H., Kniep I., Schröder AS, Burdelski C., de Heer G., Nierhaus A., Frings D., Pfefferle S., Becker H., Bredereke-Wiedling H., de Weerth A., Paschen H.-R., Sheikhzadeh-Eggers S., Stang A., Schmiedel S. , Bokemeyer C., Addo MM, Aepfelbacher M., Püschel K., Kluge S. Hallazgos de autopsia y tromboembolismo venoso en pacientes con COVID-19: un estudio de cohorte prospectivo. Ann Intern Med. 2020; 173 (4): 268–277. doi: 10.7326 / M20-2003. [ Artículo gratuito de PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ] 8. Bulfamante G., Chiumello D., Canevini MP, Priori A., Mazzanti M., Centanni S., Felisati G. Primeros hallazgos autópticos ultraestructurales de SARS -Cov-2 en vías olfativas y tronco cerebral. Minerva Anestesiol. 2020; 86 (6) doi: 10.23736 / S0375-9393.20.14772-2. [ PubMed ] [ CrossRef ] [ Google Scholar ] 9. Hamming I., Timens W., Bulthuis MLC, Lely AT, Navis GJ, van Goor H. Distribución tisular de la proteína ACE2, el receptor funcional del coronavirus del SARS. Un primer paso para comprender la patogénesis del SARS. J Pathol. 2004; 203 (2): 631–637. doi: 10.1002 / ruta.1570. [ Artículo gratuito de PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ] 10. Varga Z., Flammer AJ, Steiger P., Haberecker M., Andermatt R., Zinkernagel AS, Mehra MR, Schuepbach RA, Ruschitzka F., Moch H. Infección de células endoteliales y endotelitis en COVID-19. La lanceta. 2020; 395 (10234): 1417–1418. doi: 10.1016 / S0140-6736 (20) 30937-5. [ Artículo gratuito de PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ] 11. Mogensen TH, Vías moleculares de Paludan SR en la producción de citocinas inducida por virus. Microbiol Mol Biol Rev. 2001; 65 (1): 131–150. doi: 10.1128 / MMBR.65.1.131-150.2001. [ Artículo gratuito de PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ] 12. He Xi, Lau EHY, Wu P., Deng X., Wang J., Hao X., Lau YC, Wong JY, Guan Y., Tan X., Mo X., Chen Y., Liao B., Chen W., Hu F., Zhang Q., Zhong M., Wu Y., Zhao L., Zhang F., Cowling BJ, Li F., Leung GM Temporal dynamics in viral shedding and transmisibility of COVID-19. Nat Med. 2020; 26 (5): 672–675. doi: 10.1038 / s41591-020-0869-5. [ PubMed ] [ CrossRef ] [ Google Scholar ] 13. Lescure F.-X., Bouadma L., Nguyen D., Parisey M., Wicky P.-H., Behillil S., Gaymard A., Bouscambert-Duchamp M., Donati F., Le Hingrat Q. , Enouf V., Houhou-Fidouh N., Valette M., Mailles A., Lucet J.-C., Mentre F., Duval X., Descamps D., Malvy D., Timsit J.-F., Lina B., van-der-Werf S., Yazdanpanah Y. Datos clínicos y virológicos de los primeros casos de COVID-19 en Europa: una serie de casos. Lancet Infect Dis. 2020; 20 (6): 697–706. doi: 10.1016 / S1473-3099 (20) 30200-0. [ Artículo gratuito de PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ] 14. Lang JD, McArdle PJ, O'Reilly PJ, Matalon S. Equilibrio oxidante-antioxidante en la lesión pulmonar aguda *. Cofre. 2002; 122 (6): 314S – 320S. doi: 10.1378 / chest.122.6_suppl.314S. [ PubMed ] [ CrossRef ] [ Google Scholar ] 15. Fink MP Papel de las especies reactivas de oxígeno y nitrógeno en el síndrome de dificultad respiratoria aguda: opinión actual en cuidados intensivos . 2002; 8 (1): 6–11. doi: 10.1097 / 00075198-200202000-00002. [ PubMed ] [ CrossRef ] [ Google Scholar ] 16. Roche JA, Roche R. Una función hipotética de la señalización de bradicinina desregulada en las complicaciones respiratorias de COVID-19. FASEB j. 2020; 34 (6): 7265–7269. doi: 10.1096 / fj.202000967. [ Artículo gratuito de PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ] 17. Closa D., Folch-Puy E. Radicales libres de oxígeno y la respuesta inflamatoria sistémica. IUBMB Life (Unión Internacional de Bioquímica y Biología Molecular: Vida) 2004; 56 (4): 185-191. doi: 10.1080 / 15216540410001701642. [ PubMed ] [ CrossRef ] [ Google Scholar ] 18. Griendling KK, Sorescu D., Lassègue B., Ushio-Fukai M. Modulación de la actividad de la proteína quinasa y expresión génica por especies reactivas de oxígeno y su papel en fisiología y fisiopatología vascular. Arterioscler Thromb Vasc Biol. 2000; 20 (10): 2175–2183. doi: 10.1161 / 01.ATV.20.10.2175. [ PubMed ] [ CrossRef ] [ Google Scholar ] 19. Telek G., Ducroc R., Scoazec J.-Y., Pasquier C., Feldmann G., Rozé C. Upregulation diferencial de moléculas de adhesión celular en los sitios de estrés oxidativo en pancreatitis aguda experimental. J Surg Res. 2001; 96 (1): 56–67. doi: 10.1006 / jsre.2000.6052. [ PubMed ] [ CrossRef ] [ Google Scholar ] 20. Vaquero E., Gukovsky I., Zaninovic V., Gukovskaya AS, Pandol SJ Activación pancreática localizada de NF-kappaB y respuesta inflamatoria en la pancreatitis inducida por taurocolato. Soy J Physiol Gastrointest Liver Physiol. 2001; 280 : G1197 – G1208. doi: 10.1152 / ajpgi.2001.280.6.G1197. [ PubMed ] [ CrossRef ] [ Google Scholar ] 21. McCord JM, Roy RS La fisiopatología del superóxido: funciones en la inflamación y la isquemia. Puede J Physiol Pharmacol. mil novecientos ochenta y dos; 60 (11): 1346-1352. doi: 10.1139 / y82-201. [ PubMed ] [ CrossRef ] [ Google Scholar ] 22. Curran RD, Billiar TR, Stuehr DJ, Hofmann K., Simmons RL Los hepatocitos producen óxidos de nitrógeno a partir de L-arginina en respuesta a productos inflamatorios de las células de Kupffer. J Exp Med. 1 de noviembre de 1989; 170 (5): 1769-1774. doi: 10.1084 / jem.170.5.1769. [ Artículo gratuito de PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ] 23. Szabó C. Múltiples vías de citotoxicidad del peroxinitrito. Toxicol Lett. Abril de 2003; 11 (140-141): 105-112. doi: 10.1016 / s0378-4274 (02) 00507-6. [ PubMed ] [ CrossRef ] [ Google Scholar ] 24. Carsana L., Sonzogni A., Nasr A., Rossi RS, Pellegrinelli A., Zerbi P., Rech R., Colombo R., Antinori S., Corbellino M., Galli M., Catena E., Tosoni A., Gianatti A., Nebuloni M. Hallazgos pulmonares post-mortem en una serie de casos de COVID-19 del norte de Italia: un estudio descriptivo de dos centros. Lancet Infect Dis. 2020; 20 (10): 1135-1140. doi: 10.1016 / S1473-3099 (20) 30434-5. [ Artículo gratuito de PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ] 25. Casey LC Papel de las citocinas en la patogenia de la insuficiencia orgánica multisistémica inducida por cardiopulmonar. Cirugía de Ann Thoracic. 1993; 56 (5): S92 – S96. doi: 10.1016 / 0003-4975 (93) 91143-B. [ PubMed ] [ CrossRef ] [ Google Scholar ] 26. Lum H., Roebuck KA Estrés oxidante y disfunción de las células endoteliales. Soy J Physiol-Cell Physiol. 2001; 280 (4): C719 – C741. doi: 10.1152 / ajpcell.2001.280.4.C719. [ PubMed ] [ CrossRef ] [ Google Scholar ] 27. Yau JW, Teoh H., Verma S. Control de la trombosis por células endoteliales. Trastorno cardiovascular de BMC. 2015; 15 (1) doi: 10.1186 / s12872-015-0124-z. [ Artículo gratuito de PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ] 28. Colmenero I., Santonja C., Alonso ‐ Riaño M., Noguera ‐ Morel L., Hernández ‐ Martín A., Andina D., Wiesner T., Rodríguez ‐ Peralto JL, Requena L., Torrelo A. SARS‐ La infección endotelial por CoV ‐ 2 causa sabañones COVID ‐ 19: estudio histopatológico, inmunohistoquímico y ultraestructural de siete casos pediátricos. Br J Dermatol. 2020; 183 (4): 729–737. doi: 10.1111 / bjd.19327. [ Artículo gratuito de PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ] 29. Norsa L., Valle C., Morotti D., Bonaffini PA, Indriolo A., Sonzogni A. Isquemia intestinal en la era COVID-19. Enfermedad digestiva del hígado. 2020; 52 (10): 1090–1091. doi: 10.1016 / j.dld.2020.05.030. [ Artículo gratuito de PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ] 30. Montone RA, Iannaccone G., Meucci MC, Gurgoglione F., Niccoli G. Lesión miocárdica y microvascular debido a la enfermedad por coronavirus 2019. Eur Cardiol. 2020; 23 (15): e52. doi: 10.15420 / ecr.2020.22. [ Artículo gratuito de PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ] 31. Ghannam M., Alshaer Q., Al-Chalabi M., Zakarna L., Robertson J., Manousakis G. Participación neurológica de la enfermedad por coronavirus 2019: una revisión sistemática. J Neurol. 2020; 267 (11): 3135–3153. doi: 10.1007 / s00415-020-09990-2. [ Artículo gratuito de PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ] 32. Winterbourn CC Toxicidad del hierro y el peróxido de hidrógeno: la reacción de Fenton. Toxicol Lett. 1995; 82-83 : 969–974. doi: 10.1016 / 0378-4274 (95) 03532-X. [ PubMed ] [ CrossRef ] [ Google Scholar ] 33. Salaris SC, Babbs CF, Voorhees WD, III Azul de metileno como inhibidor de la generación de superóxido por la xantina oxidasa. Biochem Pharmacol. 1991; 42 (3): 499–506. doi: 10.1016 / 0006-2952 (91) 90311-R. [ PubMed ] [ CrossRef ] [ Google Scholar ] 34. Mayer B., Brunner F., Schmidt K. Inhibición de la síntesis de óxido nítrico por el azul de metileno. Biochem Pharmacol. 1993; 45 (2): 367–374. doi: 10.1016 / 0006-2952 (93) 90072-5. [ PubMed ] [ CrossRef ] [ Google Scholar ] 35. Denny JT, Burr AT, Balzer F., Tse JT, Denny JE, Chyu D. Tratamiento con azul de metileno para la vasoplejía asociada al síndrome de liberación de citocinas después de un trasplante renal con infusión de rATG: reporte de un caso y revisión de la literatura. Exp Ther Med. 2015; 9 (5): 1915–1920. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ] 36. Wang J., Zhao C., Kong P., Bian G., Sun Z., Sun Y., Guo Li, Li B. El azul de metileno alivia la encefalomielitis autoinmune experimental modulando la vía de señalización AMPK / SIRT1 y la vía de señalización Th17 / Treg inmune respuesta. J Neuroimmunol. 2016; 299 : 45–52. doi: 10.1016 / j.jneuroim.2016.08.014. [ PubMed ] [ CrossRef ] [ Google Scholar ] 37. Bojadzic D, Alcazar O, Buchwald P. El azul de metileno inhibe in vitro el pico de SARS-CoV-2 - Interacción proteína-proteína ACE2, un mecanismo que puede contribuir a su actividad antiviral contra COVID-19. bioRxiv [Preprint] 2020 [citado el 21 de octubre de 2020]. Disponible en https://doi.org/10.1101/2020.08.29.273441. 38. Cagno V, MedagliaC, Cerny A, Cerny T, Tapparel C, Cerny E. El azul de metileno tiene una potente actividad antiviral contra el SARS-CoV-2 en ausencia de activación UV in vitro. bioRxiv [Preprint] 2020 [citado el 21 de octubre de 2020]. Disponible en https://doi.org/10.1101/2020.08.14.251090. 39. Clifton Jack, II, Leikin Jerrold B. Azul de metileno: Am J Ther. 2003; 10 (4): 289-291. doi: 10.1097 / 00045391-200307000-00009. [ PubMed ] [ CrossRef ] [ Google Scholar ] 40. Ramsay RR, Dunford C., Gillman PK Toxicidad con azul de metileno y serotonina: la inhibición de la monoaminooxidasa A (MAO A) confirma una predicción teórica. Br J Pharmacol. 2007 Nov; 152 (6): 946–951. doi: 10.1038 / sj.bjp.0707430. [ Artículo gratuito de PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ] 41. Juffermans NP, Vervloet MG, Daemen-Gubbels CR, Binnekade JM, de Jong M., Groeneveld AB Un estudio de búsqueda de dosis de azul de metileno para inhibir las acciones del óxido nítrico en la hemodinámica del choque séptico humano. Óxido nítrico. 2010; 22 (4): 275–280. doi: 10.1016 / j.niox.2010.01.006. [ PubMed ] [ CrossRef ] [ Google Scholar ] 42. Prauchner CA Estrés oxidativo en la sepsis: Implicaciones fisiopatológicas que justifican la co-terapia antioxidante. Quemaduras 2017; 43 (3): 471–485. doi: 10.1016 / j.burns.2016.09.023. [ PubMed ] [ CrossRef ] [ Google Scholar ] 43. Rutledge C., Brown B., Benner K., Prabhakaran P., Hayes L. Un nuevo uso del azul de metileno en la UCI pediátrica. Pediatría. 2015; 136 (4): e1030 – e1034. doi: 10.1542 / peds.2014-3722. [ PubMed ] [ CrossRef ] [ Google Scholar ] 44. Alamdari DH, Amini S., Moghaddam AB, Keramati MR, Zarmehri AM, Alamdari AH Aplicación de azul de metileno -vitamina C-N-acetilcisteína para el tratamiento de pacientes con COVID-19 en estado crítico, informe de un ensayo clínico de fase I . Eur J Pharmacol. 2020; 885 : 173494. doi: 10.1016 / j.ejphar.2020.173494. [ Artículo gratuito de PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ] 45. Schirmer RH, Adler H., Pickhardt M., Mandelkow E. Para que no te olvidemos: azul de metileno. Envejecimiento de Neurobiol. 2011; 32 (12) [ PubMed ] [ Google Académico ] 46. Thayer WS Sobre el valor del azul de metileno en la fiebre palúdica. Bull Johns Hopkins Hosp. 1892; 2 (22): 49–53. [ Google Académico ] El azul de metileno inhibe la replicación del SARS-CoV-2 in vitro Int J Antimicrob Agents . 2020 dic; 56 (6): 106202. Publicado en línea el 16 de octubre de 2020 doi: 10.1016 / j.ijantimicag.2020.106202 PMCID: PMC7566888 PMID: 33075512 Mathieu Gendrot , a, b, c, 1 Julien Andreani , c, d, 1 Isabelle Duflot , c, d Manon Boxberger , c, d Marion Le Bideau , c, d Joel Mosnier , a, b, c, e Priscilla Jardot , c, d Isabelle Fonta , a, b, c, e Clara Rolland , c, d Hervé Bogreau , a, b, c, e Sébastien Hutter , c, d Bernard La Scola , c, d, ⁎⁎ y Bruno Pradines a, c, b, e, ⁎ Información del autor Información sobre derechos de autor y licencia Renuncia de responsabilidad
Resumen
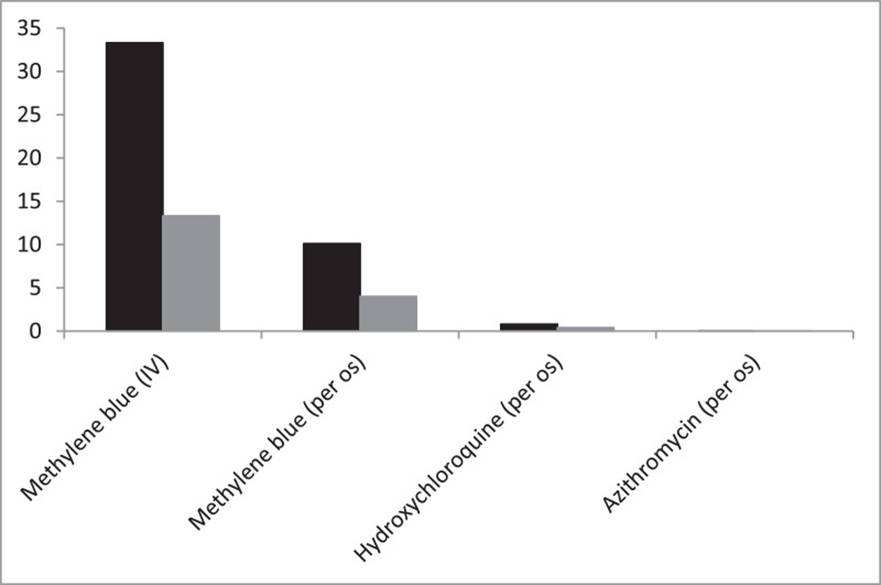
1. Introducción En diciembre de 2019, surgió en Wuhan, China, un nuevo coronavirus, el síndrome respiratorio agudo severo coronavirus (SARS-CoV-2), que causa enfermedades por coronavirus 2019 (COVID-19) [1] . A pesar de las medidas de contención, el SARS-CoV-2 se propagó en Asia, el sur de Europa, luego en América y actualmente en África. Actualmente no se recomienda un tratamiento antiviral contra el SARS-CoV-2. Se han evaluado diferentes fármacos o combinaciones en todo el mundo. Se necesita con urgencia identificar medicamentos antivirales eficaces de bajo costo con efectos secundarios limitados, asequibles de inmediato, especialmente para los países emergentes. Los productos de plasma pueden transmitir una amplia gama de patógenos por transfusión. Se sabe que el azul de metileno, un colorante de tiazina sintetizado, es eficaz en la terapia fotodinámica contra microbios y particularmente virus. El azul de metileno puede intercalarse en el ácido nucleico viral cuando se ilumina con luz visible y evita la transmisión de patógenos. Iluminación de los virus Zika, fiebre amarilla, dengue, chikungunya y Ébola inactivados con azul de metileno y coronavirus del síndrome respiratorio de Oriente Medio en plasma [2] , [3] , [4] , [5] . El azul de metileno también muestra actividades antimicrobianas sin fotoactivación. El azul de metileno inhibió in vitro cepas de colistina resistentes aAcinetobacter baumannii, Mycobacterium ulcerans, Mycobacterium spp. y Candida albicans [6] , [7] , [8] . El azul de metileno también fue eficaz in vivo contra la úlcera de Buruli en la infección experimental por M. ulcerans en ratones [7] . Además, el azul de metileno inactivó el virus del hígado C en el órgano de trasplante perfundido con azul de metileno [9] . Los efectos más estudiados del azul de metileno son los de la malaria. En 1891, el azul de metileno se utilizó por primera vez para tratar eficazmente a dos pacientes con paludismo no complicado [10] . En la década de 2010, el azul de metileno mostró una actividad in vitro eficaz en el rango nanomolar contra cepas de Plasmodium falciparum [11] , [12] , [13] , [14] . El azul de metileno mostró un efecto protector contra la malaria cerebral en un modelo murino infectado con Plasmodium berghei [15] , [16] , [17] . El azul de metileno mostró varios beneficios cuando se usó como asociado en una combinación triple con la terapia combinada basada en artemisinina en el paludismo por P. falciparum no complicado en niños [18] . En conjunto, estos informes sugieren que el azul de metileno puede tener efectos antivirales contra el SARS-CoV-2. Por lo tanto, en este estudio se evaluó la actividad del azul de metileno in vitro frente a una cepa de SARS-CoV-2 clínicamente aislada y se comparó con la actividad de la hidroxicloroquina y la azitromicina, que ya se han evaluado in vitro e in vivo en humanos [19]. , [20] , [21] , [22] . 2. Materiales y métodos 2.1. Células, virus y medicamentos antimaláricos El azul de metileno (cloruro de metiltioninio; Proveblue Ⓡ ) fue proporcionado por Provepharm SAS (Marsella, Francia). Se prepararon soluciones madre de hidroxicloroquina (Sigma, St Louis, MO, EE.UU.) y azul de metileno en agua y se preparó azitromicina (Sigma) en metanol. Luego, todas las soluciones madre se diluyeron en Medio Esencial Mínimo (MEM) (Gibco, Thermo Fisher) para lograr siete concentraciones finales que oscilan entre 0,1 y 100 μM. Una cepa de SARS-CoV-2 (IHUMI-3) [23] clínicamente aislada se mantuvo en producción en células Vero E6 (American Type Culture Collection ATCC Ⓡ CRL-1586 ™) en MEM con 4% de suero fetal bovino (FBS) y Glutamina al 1% (medio completo). 2.2. Ensayo de citotoxicidad La evaluación de la viabilidad celular in vitro utilizando la línea celular Vero E6 se realizó de acuerdo con el método descrito por Mosmann con ligeras modificaciones [24] . En resumen, 10 5 Se añadieron células en 200 l de medio completo a cada pocillo de placas de 96 pocillos y se incubaron a 37 ° C en una atmósfera humidificada con 5% de CO 2 atmósfera. Luego de 24 h de incubación, se adicionaron 25 μL de medio completo y 25 μL de cada concentración de azul de metileno, hidroxicloroquina o azitromicina y las placas se incubaron por 48 ha 37 ° C. Después de eliminar el sobrenadante, 100 μL de MTT [3- (4,5-dimetil-2-tiazolil) -2,5-difenil-2 H-bromuro de tetrazolio] (Sigma-Aldrich, Francia) (0,5 mg / ml en MEM sin FBS) se añadieron a cada pocillo. Las células se incubaron durante 2 horas a 37 ° C. Después de la incubación, se eliminó la solución de MTT y se añadieron 100 µl de dimetilsulfóxido (DMSO) para disolver los cristales de formazán. A continuación, las placas se agitaron a 700 rpm durante 10 min a 37ºC. La absorbancia se midió a 570 nm usando un lector de microplacas Tecan Infinite F200. Se utilizó DMSO como blanco. La concentración citotóxica al 50% (CC 50 ) se calculó con un modelo inhibidor sigmoide E max , que estimó el CC 50 mediante regresión no lineal utilizando una función estándar del software R (ICEstimator v.1.2; http: // www. antimalárico-icestimator.net ). El CC 50 El valor fue la media de seis experimentos diferentes. 2.3. Ensayo de actividad antiviral Brevemente, placas de 96 pocillos se prepararon con 5 × 10 5 células / ml de células Vero E6 (200! L por pocillo) como se describió previamente [20] . Se agregaron concentraciones de azul de metileno, hidroxicloroquina o azitromicina 4 h antes de la infección. Se infectaron células Vero E6 con la cepa IHUMI-3 de SARS-CoV-2 con una multiplicidad de infección (MOI) de 0,25. A las 48 h posteriores a la infección, se estimó la replicación mediante RT-PCR utilizando un kit de un solo paso SuperScript TM III Platinum TM con ROX (Invitrogen) después de la extracción con un kit BIoExtract Ⓡ SuperBall Ⓡ (Biosellal, Dardilly, Francia). Los cebadores utilizados se han descrito anteriormente [25] . El EC 50(concentración efectiva media) y EC 90 (concentración efectiva del 90%) se calcularon con un modelo sigmoide E max inhibidor , que estimó la EC 50 y EC 90 mediante regresión no lineal utilizando una función estándar del software R (ICEstimator v.1.2 ). Los valores de EC 50 y EC 90 fueron la media de seis experimentos diferentes. 2.4. Análisis e interpretación de datos El índice de selectividad (SI) se estimó para cada fármaco como la relación CC 50 / CE 50 . La concentración sanguínea máxima esperada ( C max ) se estimó a partir de la literatura para cada fármaco en las dosis comúnmente administradas en el tratamiento oral de la malaria y para el azul de metileno en dosis intravenosas (iv) utilizadas por la Administración de Alimentos y Medicamentos de los EE. Tratamiento de metahemoglobinemia aprobado por EMA). Las relaciones C max / EC 50 y C max / EC 90se estimaron para determinar si la concentración efectiva en plasma para curar el SARS-CoV-2 es alcanzable en humanos. Si se disponía de datos sobre la acumulación de fármaco en el pulmón, se calcularon las relaciones C pulmón / CE 50 y C pulmón / CE 90 . 3. Resultados Los CC 50 , EC 50 , EC 90 y SI de cada fármaco se presentan entabla 1 . El azul de metileno y la hidroxicloroquina mostraron valores de CE 50 y CE 90 en el rango micromolar bajo (tabla 1). Los valores de CE 50 y CE 90 para el azul de metileno fueron inferiores a los obtenidos para la hidroxicloroquina y la azitromicina. Las relaciones C max / EC 50 y C max / EC 90 en sangre para el azul de metileno se estimaron en 10,1 y 4,0, respectivamente, tras la administración oral y en 33,3 y 13,3 tras la administración iv (Figura 1 ). tabla 1 Valores EC 50 y EC 90 frente a SARS-CoV-2, CC 50 e índice de selectividad (SI) para azul de metileno, hidroxicloroquina y azitromicina
CE 50 , la concentración efectiva media; EC 90 , concentración efectiva del 90%; SARS-CoV-2, síndrome respiratorio agudo severo coronavirus 2; CC 50 , concentración citotóxica al 50%. a En celdas Vero E6.
Gráfico de barras que muestra las relaciones C máx / CE 50 (negro) y C máx / CE 90 (gris) para el azul de metileno, hidroxicloroquina y azitromicina para la actividad in vitro contra el SARS-CoV-2 (síndrome respiratorio agudo severo coronavirus 2). C max , concentración máxima en sangre; CE 50 , la concentración efectiva media; EC 90 , concentración efectiva del 90%. 4. Discusión El azul de metileno mostró actividad in vitro en un rango micromolar muy bajo con una CE 50 de 0,30 ± 0,03 μM y una CE 90 de 0,75 ± 0,21 μM a una MOI de 0,25 (SI> 333) (tabla 1). Los valores de CE 50 y CE 90 para el azul de metileno son inferiores a los obtenidos para la hidroxicloroquina y la azitromicina. La azitromicina demostró una baja eficacia in vitro contra el SARS-CoV-2 cuando se usó sola, pero potenció los efectos de la hidroxicloroquina en combinación [20] . La captación oral de 325 mg de azul de metileno condujo a una C máx en sangre de 0,97 μg / ml (~ 3 µM) y una vida media de eliminación ( t 1/2 ) de 14,9 h [26] . Una dosis de azul de metileno de 2 mg / kg iv mostró una C max de 2,917 μg / ml (~ 10 μM) [27] . Las relaciones C max / EC 50 y C max / EC 90 para el azul de metileno se estimaron en 10,1 y 4,0 para la vía oral y 33,3 y 13,3 para la vía iv, respectivamente. Los valores de CE 50 y CE 90 del azul de metileno son consistentes con las concentraciones observadas en sangre humana. Aproximadamente el 3-5% de azul de metileno por gramo de pulmón se encontró después de la inyección intravenosa de azul de metileno, pero la concentración de azul de metileno disminuyó rápidamente por debajo del 0,1% después de 10 h [28] . En comparación, la absorción oral de 400 mg de hidroxicloroquina condujo a una C max de 1,22 µM [29] . La hidroxicloroquina se acumuló 30 veces más en los pulmones que en la sangre [30] . La azitromicina C maxosciló entre 0,18 y 0,4 μg / ml de sangre (~ 0,22-0,51 μM) después de la última dosis de administración oral de 500 mg una vez al día durante 3 días o después de una dosis única de 500 mg [31] , [32] , [33 ] . Estas dosis condujeron a una C max en el pulmón de 8 a 9 μg / g (~ 10 a 12 μM) [ 31 , 32 ]. La C max esperada en el pulmón estaba por debajo de EC 50 y EC 90 . Sin embargo, debido a la potenciación de los efectos antivirales cuando la azitromicina se combina con hidroxicloroquina, la azitromicina puede usarse in vitro en concentraciones más bajas (5 µM y 10 µM) [20].. Estas concentraciones son compatibles con las concentraciones esperadas en los pulmones. El azul de metileno mostró baja citotoxicidad in vitro contra células Vero E6 con CC 50 > 100 μM. Se estimó que el SI como una relación CC 50 / EC 50 era> 333. El CC 50 actual de hidroxicloroquina con un SI de ~ 13 contra las células Vero E6 fue más alto que los valores CC 50 previamente informados , que van desde> 50 μM a 250 μM contra las células Vero E6 [ 19 , 34 ] o> 500 μM en Felis catus entero células feto-4 [35] . La azitromicina también mostró una baja citotoxicidad contra las células Vero E6 con CC 50 > 100 μM y SI> 5. La CC 50 para azitromicina fue consistente con los datos anteriores (> 130 μM)[34] . El azul de metileno mostró una citotoxicidad baja pero predominantemente el mayor IS. Aunque el azul de metileno está en la lista de fármacos potencialmente peligrosos para los pacientes con deficiencia de glucosa-6-fosfato deshidrogenasa (G6PD), no se ha detectado asociación entre el azul de metileno y la hemólisis grave después de la administración oral [36] . Además, la vía iv para el azul de metileno recibió una autorización de comercialización en Europa en 2011 y en los EE. UU. En 2016 para el tratamiento de la metahemoglobinemia adquirida en función de una relación beneficio / riesgo positiva confirmada en esta patología. 5. Conclusión El azul de metileno mostró una alta actividad antiviral eficaz in vitro contra el SARS-CoV-2 con una CI 50 (0,3 µM) y una CI 90 (0,75 µM) compatible con la captación oral y la administración iv. Esta actividad in vitro es superior a la obtenida con fármacos que han sido evaluados en ensayos clínicos a nivel mundial como hidroxicloroquina (1,5 μM), azitromicina (20,1 μM), remdesivir (23 μM), lopinavir (26,6 μM) o ritonavir (> 100 μM ) [37] . Proponemos que el azul de metileno es un fármaco prometedor para el tratamiento de COVID-19. Ahora se requiere una evaluación in vivo en modelos experimentales con animales para confirmar sus efectos antivirales contra el SARS-CoV-2. El interés potencial del azul de metileno para tratar COVID-19 debe confirmarse mediante estudios clínicos comparativos prospectivos. Reconocimiento Los autores agradecen a Provepharm por proporcionar el azul de metileno (Proveblue Ⓡ ). Financiamiento: Este estudio fue financiado por el Institut Hospitalo-Universitaire (IHU) Méditerranée Infection, la Agencia Nacional de Investigación en el marco del programa «Investissements d'avenir» [referencia ANR-10-IAHU-03]. Intereses en competencia: BLS y BP están asociados como co-inventores con Provepharm en la patente EP 20305425.9 (30/04/2020) pero no tienen ningún interés financiero con el tema; MB recibió una beca de doctorado respaldada por L'Occitane Society. Provepharm o los patrocinadores no tuvieron ningún papel en el diseño del estudio, en la recopilación, análisis o interpretación de los datos, en la redacción del manuscrito o en la decisión de publicar los resultados. Todos los demás autores declaran no tener intereses en competencia. Aprobación ética: No se requiere. Referencias 1. Wu F, Zhao S, Yu B, Chen YM, Wang W, Song ZG. Un nuevo coronavirus asociado con enfermedades respiratorias humanas en China. Naturaleza. 2020; 579 : 365–369. [ Google Académico ] 2. Fryk JJ, Marks DC, Hobson-Peters J, Prow NA, Watterson D, Hall RA. Los virus del dengue y chikungunya en plasma se inactivan eficazmente después del tratamiento con azul de metileno y luz visible. Transfusión. 2016; 56 : 2278–2285. [ PubMed ] [ Google Académico ] 3. Faddy HM, Fryk JJ, Hal RA, Young PR, Reichenberg S, Tolksdorf F. Inactivación del virus de la fiebre amarilla en plasma después del tratamiento con azul de metileno y luz visible y en concentrados de plaquetas después del tratamiento con luz ultravioleta C. Transfusión. 2019; 59 : 2223–2227. [ PubMed ] [ Google Académico ] 4. Wang Y, Ren K, Liao X, Luo G, Kumthip K, Leetrakool N. Inactivación del virus del Zika en plasma y derivados mediante cuatro métodos diferentes. J Med Virol. 2019; 91 : 2059-2065. [ PubMed ] [ Google Académico ] 5. Eickmann M, Gravemann U, Handke W, Tolksdorf F, Reichenberg S, Müller TH. Inactivación del coronavirus del virus del Ébola y del síndrome respiratorio de Oriente Medio en concentrados de plaquetas y plasma por luz ultravioleta C y azul de metileno más luz visible, respectivamente. Transfusión. 2018; 58 : 2202–2207. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ] 6. Gazel D, Tatman Otkun M, Akçali A. Actividad in vitro del agar azul de metileno y azul de metileno de eosina en A. baumannii resistente a la colistina : un estudio experimental. J Med Microbiol. 2019; 68 : 1607–1613. [ PubMed ] [ Google Académico ] 7. Tian RBD, Asmar S, Napez C, Lépidi H, Drancourt M. Eficacia del azul de metileno purificado en un modelo experimental de infección por Mycobacterium ulcerans . Agentes antimicrobianos Int J. 2017; 49 : 290–295. [ PubMed ] [ Google Académico ] 8. Pal R, Ansari MA, Saibabu V, Das S, Fatima Z, Hameed S. Roles no fotodinámicos del azul de metileno: visualización de modos de acción distintos antimicobacterianos y anticandidal. J Pathog. 2018; 2018 [ artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ] 9. Helfritz FA, Bojkova D, Wanders V, Kuklinski N, Westhaus S, von Horn C. El tratamiento de los injertos con azul de metileno durante el tiempo de isquemia fría reduce el riesgo de transmisión del virus de la hepatitis C. J Infect Dis. 2018; 218 : 1711-1721. [ PubMed ] [ Google Académico ] 10. Guttman P, Ehrlich P. Ueber die Wirkung des Methylenblau bei Malaria [Acerca del efecto del azul de metileno en la malaria] Berl Klin Wochenschr. 1891; 28 : 953–956. [ Google Académico ] 11. Pascual A, Henry M, Briolant S, Charras S, Baret E, Amalvict R. Actividad in vitro de Proveblue (azul de metileno) en cepas de Plasmodium falciparum resistentes a los medicamentos antipalúdicos estándar. Agentes antimicrobianos Chemother. 2011; 55 : 2472–2474. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ] 12. Otoño B, Camara C, Otoño M, Nakoulima A, Dionne P, Diatta B. Plasmodium falciparum susceptibilidad a fármacos antipalúdicos estándar y potenciales en Dakar, Senegal, durante la temporada de paludismo 2013-2014. Malar J. 2015; 14 : 60. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ] 13. Fall B, Madamet M, Diawara S, Briolant S, Wade KA, Lo G. Actividad ex vivo de Proveblue, un azul de metileno, contra cepas aisladas de Plasmodium falciparum en Dakar, Senegal de 2013 a 2015. Int J Antimicrob Agents. 2017; 50 : 155-158. [ PubMed ] [ Google Académico ] 14. Gendrot M, Madamet M, Mosnier J, Fonta I, Amalvict R, Benoit N. Distribución basal y multinormal de las susceptibilidades ex vivo de Plasmodium falciparum al azul de metileno en África, 2013–18. J Antimicrob Chemother. 2020; 75 : 2141–2148. [ PubMed ] [ Google Académico ] 15. Dormoi J, Pradines B. Respuestas a la dosis de azul de metileno Proveblue en un modelo experimental de paludismo cerebral murino. Agentes antimicrobianos Chemother. 2013; 57 : 4080–4081. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ] 16. Dormoi J, Briolant S, Desgrouas C, Pradines B. Eficacia de Proveblue (azul de metileno) en un modelo murino de malaria cerebral experimental. Agentes antimicrobianos Chemother. 2013; 57 : 3412–3414. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ] 17. Dormoi J, Briolant S, Desgrouas C, Pradines B. Impacto de la terapia de combinación de azul de metileno y atorvastatina en la aparición de malaria cerebral en un modelo murino. Malar J. 2013; 12 : 127. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ] 18. Mendes Jorge M, Ouermi L, Meissner P, Compaoré G, Coulibaly B, Nebie E. Seguridad y eficacia de artesunato-amodiaquina combinada con azul de metileno o primaquina en niños con paludismo falciparum en Burkina Faso: un ensayo controlado aleatorio. Más uno. 2019; 14 [ artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ] 19. Liu J, Cao R, Xu M, Wang X, Zhang H, Hu H. La hidroxicloroquina, un derivado menos tóxico de la cloroquina, es eficaz para inhibir la infección por SARS-CoV-2 in vitro. Cell Discov. 2020; 6 : 16. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ] 20. Andreani J, Le Bideau M, Duflot I, Jardot P, Rolland C, Boxberger M. Las pruebas in vitro de hidroxicloroquina y azitromicina sobre el SARS-CoV-2 muestran un efecto sinérgico. Microb Pathog. 2020; 145 [ artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ] 21. Gautret P, Lagier JC, Parola P, Hoang VT, Meddeb L, Sevestre J. Efecto clínico y microbiológico de una combinación de hidroxicloroquina y azitromicina en 80 pacientes con COVID-19 con al menos un seguimiento de seis días: un estudio observacional . Travel Med Infect Dis. 2020; 34 [ artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ] 22. Million M, Lagier JC, Gautret P, Colson P, Fournier PE, Amrane S. Tratamiento temprano de 1061 pacientes con COVID-19 con hidroxicloroquina y azitromicina, Marsella, Francia. Travel Med Dis. 2020; 35 [ artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ] 23. Gautret P, Lagier JC, Parola P, Hoang VT, Meddeb L, Mailhe M. Hidroxicloroquina y azitromicina como tratamiento de COVID-19: resultados de un ensayo clínico abierto no aleatorizado. Agentes antimicrobianos Int J. 2020; 56 [ artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ] 24. Mosmann T. Ensayo colorimétrico rápido para crecimiento y supervivencia celular: aplicación a ensayos de proliferación y citotoxicidad. Métodos J Immunol. 1983; 65 : 55–63. [ PubMed ] [ Google Académico ] 25. Amrane S, Tissot-Dupont H, Doudier B, Eldin C, Hocquart M, Mailhe M. Diagnóstico viral rápido y manejo ambulatorio de casos sospechosos de COVID-19 que se presentan en el hospital de referencia de enfermedades infecciosas en Marsella, Francia, 31 de enero a marzo 1 de febrero de 2020: una instantánea de virus respiratorios. Travel Med Infect Dis. 2020; 36 [ artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ] 26. Anh CX, Chavchich M, Birrell GW, van Breda K, Travers T, Rowcliffe K. Farmacocinética y actividad antipalúdica ex vivo de artesunato-amodiaquina más azul de metileno en voluntarios sanos. Agentes antimicrobianos Chemother. 2020; 64 e01441-19. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ] 27. Centro de Evaluación e Investigación de Medicamentos. Octubre de 2020. Revisión (es) de farmacología clínica y biofarmacéutica: número de solicitud 204630Orig1s000. https://www.accessdata.fda.gov/drugsatfda_docs/nda/2016/204630Orig1s000ClinPharmR.pdf [consultado el 16 de octubre de 2020] [ Google Scholar ] 28. Enlace EM, Costa DC, Lui D, Ell PJ, Lower PJ, Spittle MF. Dirigirse al melanoma diseminado con azul de metileno radiomarcado. Acta Oncol. 1996; 35 : 331–341. [ PubMed ] [ Google Académico ] 29. Rainsford KD, Parke AL, Clifford-Rashotte M, Kean WF. Terapia y propiedades farmacológicas de la hidroxicloroquina y la cloroquina en el tratamiento del lupus eritematoso sistémico, la artritis reumatoide y enfermedades relacionadas. Inflammatofarmacología. 2015; 23 : 231-269. [ PubMed ] [ Google Académico ] 30. Chhonker YS, Sleightholm RL, Li J, Oupicky D, Murry DJ. Cuantificación simultánea de hidroxicloroquina y sus metabolitos en sangre y tejidos de ratón mediante LC-ESI-MS / MS: una aplicación para estudios farmacocinéticos. J Chromatogr B Analyt Technol Biomed Life Sci. 2018; 1072 : 320–327. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ] 31. Danesi R, Lupetti A, Barbara C, Ghelardi E, Chella A, Malizia T. Distribución comparativa de azitromicina en el tejido pulmonar de un paciente que recibió dosis diarias orales de 500 y 1000 mg. J Antimicrob Chemother. 2003; 51 : 939–945. [ PubMed ] [ Google Académico ] 32. Lucchi M, Damle B, Fang A, de Caprariis PJ, Mussi A, Sanchez SP. Farmacocinética de azitromicina en suero, lavados bronquiales, macrófagos alveolares y tejido pulmonar después de una dosis oral única de formulaciones de azitromicina de liberación prolongada o inmediata. J Antimicrob Chemother. 2008; 61 : 884–891. [ PubMed ] [ Google Académico ] 33. Davidson RJ. Actividad in vitro y parámetros farmacodinámicos / farmacocinéticos de claritromicina y azitromicina: por qué son importantes en el tratamiento de infecciones del tracto respiratorio. Infectar resistente a los fármacos. 2019; 12 : 585–596. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ] 34. Madrid PB, Panchal RG, Warren TK, Shurleff AC, Endsley AN, Green CE. Evaluación de inhibidores del virus del Ébola para la reutilización de fármacos. ACS Infect Dis. 2015; 1 : 317–326. [ PubMed ] [ Google Académico ] 35. Takano T, Satoh K, Doki T, Tanabe T, Hohdatsu T. Efectos antivirales de la hidroxicloroquina y el interferón tipo I sobre la infección fatal por coronavirus felino in vitro. Virus. 2020; 12 : 576. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ] 36. Lu G, Nagbanshi M, Goldau N, Mendes Jorge M, Meissner P, Jahn A. Eficacia y seguridad del azul de metileno en el tratamiento de la malaria: una revisión sistémica. BMC Med. 2018; 16 : 59. [ Artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ] 37. Choy KT, Wong AYL, Kaewpreedee P, Sia SF, Chen D, Hui KPY. Remdesivir, lopinavir, emetine y homoharringtonine inhiben la replicación del SARS-CoV-2 in vitro. Antiviral Res. 2020; 178 [ artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ] COVID-19 debe ser un "promotor" de azul de metileno Braz J Cardiovasc Surg . 2020 julio-agosto; 35 (4): 604–605. doi: 10.21470 / 1678-9741-1-2020-0607 PMCID: PMC7454620 PMID: 32864945 Paulo Roberto B. Evora , MD, PhD 1 Información del autor Información sobre derechos de autor y licencia Renuncia de responsabilidad Al editor, Desde los años setenta, cuando inicié mis labores de cuidados intensivos y cirugía cardíaca, continúo con total inconformidad ante la muerte, especialmente cuando se pierden batallas significativas, por ejemplo, contra el shock séptico en mujeres jóvenes con infecciones ginecológicas, así como como pacientes que mueren de shock anafiláctico. Incluso con el compromiso constante y creciente de salvar vidas, como las de los jóvenes mencionados anteriormente, seguimos perdiendo la batalla contra la infección / inflamación. En este momento, estamos luchando contra la pandemia de COVID-19, cuya fisiopatología seguramente incluye inflamación y disfunción vaspléjica dependiente del endotelio NO-cGMP. Algunas observaciones bien conocidas deben mencionarse una y otra vez, basadas en lo que se ha aprendido sobre el bloqueo de la vía NO-cGMP en el tratamiento de la disfunción endotelial vaspléjica para sintetizar conceptos: 1. El uso de azul de metileno (MB) no causa disfunción endotelial. 2. El efecto MB aparece en casos sin regulación positiva de NO. 3. El MB en sí no es un vasoconstrictor. Al bloquear la vía cGMP, libera la vía cAMP, facilitando el efecto vasoconstrictor de la epinefrina a través de este mecanismo de "diafonía". 4. La dosis más utilizada es de 2 mg / kg en bolo IV, seguida de la misma infusión continua cada hora. La concentración plasmática disminuye drásticamente en los primeros 40 minutos. 5. MB tiene un efecto antioxidante. Con base en estos conceptos, seguimos salvando vidas, y con la certeza de que el bloqueo de la vía NO-cGMP por MB aún se ha subestimado al menos durante más de 100 años. Sin embargo, muchos profesionales de la salud nombraron a MB como una "solución mágica de rescate". Vi COVID-19 dentro de este escenario y, en marzo pasado, escribí una carta al Editor en Jefe de The Lancet titulada "¿DEBE CONSIDERARSE EL AZUL DE METILENO COMO 'BALA MÁGICA DE RESCATE' CONTRA EL NUEVO CORONAVIRUS?" El método basado en MB / luz se ha utilizado habitualmente en Europa durante unos 17 a 18 años. Las unidades de plasma de donaciones de sangre se iluminan con luz visible en presencia de MB. El tratado con MB / luz genera oxígeno singlete, que conduce a la destrucción de los ácidos nucleicos virales. Los grupos emergentes incluyen el coronavirus del síndrome respiratorio agudo severo (SARS-CoV), el virus de la fiebre hemorrágica de Crimea-Congo (CCHFV) y el virus Nipah (NiV), que han sido identificados por la Organización Mundial de la Salud (OMS) como las principales amenazas infecciosas con el potencial de causar una pandemia mundial [ 1 - 3 ]. Paul Ehrlich, obsesionado con la química orgánica estructural y los tintes, elaboró su teoría sobre el descubrimiento de una “bala mágica”. Basado en todos sus descubrimientos científicos, ganó el Premio Nobel en 1908, con énfasis en el tratamiento de la malaria con MB. ¿Debería MB, un precursor de la hidroxicloroquina, ser una “bala mágica de rescate” contra el nuevo coronavirus? Si alguien opta por probar la idea, sugiero, como prueba terapéutica, un bolo intravenoso inicial de 1 mg / kg. En nuestra experiencia en el tratamiento del síndrome vasopléjico, la dosis más alta es de 7 mg / kg en infusión intravenosa continua [ 4 ] . The Lancet Global Health, en esta ocasión, decidió no publicar la carta porque creen que “el mensaje encajaría mejor en otro lugar”. Estuve de acuerdo con la decisión y, durante mi cuarentena de COVID-19, mantuve mi rutina de consultas de Google “azul de metileno y COVID-19”. De repente ... una explosión de casi tres millones de papeles (Figura 1).
Evolución del número total de citas recopiladas como resultado de una consulta genérica (azul de metileno y COVID-19) (Google). En ese momento, dos citas filosóficas me motivaron a reescribir la carta rechazada: “La medicina es la ciencia de la incertidumbre y el arte de la probabilidad” (William Osler) y “Nada te pertenece más que tus sueños” (Friedrich Nietzsche). Decidí volver a enviar la carta ahora, considerando que COVID-19 debería ser un “promotor” de azul de metileno, y el tinte puede obtener el estatus de salvamento que se merece. REFERENCIAS 1. Eickmann M, Gravemann U, Handke W, Tolksdorf F, Reichenberg S, Müller TH, et al. Inactivación de tres virus emergentes - coronavirus del síndrome respiratorio agudo severo, virus de la fiebre hemorrágica de Crimea-Congo y virus de Nipah - en concentrados de plaquetas por luz ultravioleta C y en plasma por azul de metileno más luz visible. Vox Sang. 2020; 115 (3): 146-151. doi: 10.1111 / vox.12888. [ Artículo gratuito de PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ] 2. Stramer SL, Hollinger FB, Katz LM, Kleinman S, Metzel PS, Gregory KR, et al. Agentes de enfermedades infecciosas emergentes y su potencial amenaza para la seguridad de las transfusiones. Transfusión. 2009; 49 (Supl. 2): 1S – 29S. doi: 10.1111 / j.1537-2995.2009.02279.x. [ PubMed ] [ CrossRef ] [ Google Scholar ] 3. Stramer SL. Perspectivas actuales en enfermedades infecciosas transmitidas por transfusiones: infecciones emergentes y reemergentes. ISBT Sci Ser. 2014; 9 (1): 30–36. doi: 10.1111 / voxs.12070. [ Artículo gratuito de PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ] 4. Evora PR, Alves Junior L, Ferreira CA, Menardi AC, Bassetto S, Rodrigues AJ, et al. Veinte años de tratamiento del síndrome vasopléjico en cirugía cardíaca. Azul de metileno revisado. Rev Bras Cir Cardiovasc. 2015; 30 (1): 84–92. doi: 10.5935 / 1678-9741.20140115. [ Artículo gratuito de PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ] Metahemoglobinemia inexplicable en la enfermedad por coronavirus 2019: informe de un caso Los artículos de la Revista Brasileña de Cirugía Cardiovascular se proporcionan aquí por cortesía de Sociedade Brasileira de Cirurgia Cardiovascular AA Pract . 2020 julio; 14 (9): e01287. Publicado en línea el 16 de julio de 2020. Doi: 10.1213 / XAA.0000000000001287 PMCID: PMC7373357 PMID: 32909713
Hina Faisal ,
MD, MRCS, * Alexi
Bloom , MD, † y A.
Osama Gaber ,
MD, FACS ‡ § Información del autor Notas del artículo Información sobre derechos de autor y licencia Renuncia de responsabilidad Este artículo ha sido citado por otros artículos en PMC.
Resumen
La metahemoglobinemia es una afección poco común en la que el hierro de la hemoglobina está presente en el estado férrico (Fe 3+ ), no en el estado ferroso (Fe 2+ ) de la hemoglobina normal, que hace que los glóbulos rojos no puedan liberar oxígeno a los tejidos y produce anemia funcional. y conduce a hipoxia tisular. 1 La metahemoglobinemia está presente si las concentraciones de metahemoglobina en la sangre exceden los niveles fisiológicos normales de 1% a 2%. 2 La metahemoglobinemia puede ser congénita debido a deficiencias de metahemoglobina reductasa o anomalías estructurales de la hemoglobina. La metahemoglobinemia puede adquirirse, por lo general secundaria a la exposición a fármacos o sustancias químicas que oxidan la hemoglobina y, en ocasiones, a enfermedades patológicas, como sepsis y crisis de células falciformes. Los medicamentos rara vez producen metahemoglobinemia clínicamente significativa cuando se administran a un adulto sano en dosis terapéuticas. Algunos fármacos oxidantes requieren una transformación bioquímica en el hígado en metabolitos tóxicos después de la exposición, y la metahemoglobinemia ocurre varias horas después. 2 El riesgo de metahemoglobinemia asociado con el uso de fármacos oxidantes aumenta en pacientes de edad avanzada con comorbilidades médicas como insuficiencia renal, anemia y virus de inmunodeficiencia humana. 3Las nuevas proteínas del coronavirus pueden alterar la estructura de la hemoglobina, lo que puede interferir con la capacidad de los glóbulos rojos para transportar oxígeno. 4 Presentamos un caso de hipoxia refractaria por metahemoglobinemia adquirida en un paciente crítico con enfermedad por coronavirus 2019 (COVID-19), que no se manejó con éxito solo con azul de metileno, sino que requirió transfusión de concentrados de glóbulos rojos. La autorización de la Ley de Portabilidad y Responsabilidad del Seguro Médico se obtuvo del paciente para la publicación de este informe de caso. Este manuscrito se adhiere a las pautas de la red de investigación en salud aplicable para mejorar la calidad y la transparencia. DESCRIPCIÓN DEL CASO Un hombre afroamericano jubilado de 74 años con antecedentes médicos importantes de cáncer de próstata, hipertensión e hiperlipidemia, se presentó en nuestras instalaciones con un historial de 7 días de fiebre, tos no productiva y dificultad para respirar que empeora progresivamente. Nunca había viajado a China ni había tenido contacto con un paciente conocido de COVID-19. En el examen, tenía taquipnea con saturación de oxígeno medida por oximetría de pulso (Sp o 2) del 90% en aire ambiente. Las pruebas de laboratorio revelaron un panel de patógenos respiratorios negativos y un frotis nasofaríngeo positivo para el síndrome respiratorio agudo severo coronavirus-2 en el ensayo de reacción en cadena de la polimerasa. La radiografía de tórax (figura) mostró opacidades perihiliares bilaterales y del lóbulo inferior derecho. La paciente fue ingresada en el piso con diagnóstico de neumonía asociada a COVID-19 y tratada con oxígeno suplementario, azitromicina oral e hidroxicloroquina (tabla). Su estado respiratorio empeoró el quinto día de hospitalización con un aumento de las necesidades de oxígeno. Posteriormente fue trasladado a una unidad de cuidados intensivos (UCI) con insuficiencia respiratoria hipóxica aguda y síndrome de dificultad respiratoria aguda por lo que requirió intubación y ventilación mecánica. Su régimen de tratamiento incluía lopinavir-ritonavir, ribavirina y tocilizumab (tabla), y no era candidato para la prueba de terapia con remdesivir de nuestro hospital. La neumonía por Corynebacterium, la insuficiencia renal aguda, el shock séptico y el síndrome inflamatorio por liberación de citocinas complicaron aún más su curso hospitalario. El paciente requirió de forma intermitente terapia de reemplazo renal. Fue tratado con antibióticos intravenosos apropiados, una segunda dosis de tocilizumab, tiamina, hidrocortisona, ácido ascórbico (vitamina C) y una infusión breve de norepinefrina. Durante los días siguientes, su estado respiratorio mejoró con una tensión arterial de oxígeno normal (Pa Fue tratado con antibióticos intravenosos apropiados, una segunda dosis de tocilizumab, tiamina, hidrocortisona, ácido ascórbico (vitamina C) y una infusión breve de norepinefrina. Durante los días siguientes, su estado respiratorio mejoró con una tensión arterial de oxígeno normal (Pa Fue tratado con antibióticos intravenosos apropiados, una segunda dosis de tocilizumab, tiamina, hidrocortisona, ácido ascórbico (vitamina C) y una infusión breve de norepinefrina. Durante los días siguientes, su estado respiratorio mejoró con una tensión arterial de oxígeno normal (Pao 2 ) en modo de ventilación de soporte adaptativo de ventilador con presión positiva al final de la espiración (PEEP) de 8 mm Hg y fracción de oxígeno inspirado del 40% (Fi o 2 ). Aclaró su neumonía y su función renal comenzó a recuperarse. Debido a las secreciones excesivas y la necesidad frecuente de aspiración, no se indicó la extubación. Mesa. Cronología de los tratamientos COVID-19 a
Abreviaturas: COVID-19, enfermedad por coronavirus 2019; HD, día de hospital. a La tabla compara la fecha de diagnóstico de metahemoglobinemia en la HD 15 y la duración y finalización del tratamiento con COVID-19.
Radiografía de tórax del paciente en la presentación inicial que muestra opacidades perihiliares bilaterales y del lóbulo inferior derecho. El día 15 de hospitalización, desarrolló hipoxia severa con Sp o 2 80% -90% con formas de onda apropiadas en el monitor. La hipoxia no mejoró a pesar de la transición para ayudar a controlar la ventilación con PEEP de 12 mm Hg y 100% de Fi o 2 . La gasometría arterial reveló una Pa o 2 elevada de 311 mm Hg y una saturación arterial de oxígeno (Sa o 2 ) del 100%, que eran discordantes con la Sp o 280% –90%. La radiografía de tórax se mantuvo sin cambios con respecto al día anterior. La metahemoglobina y la carboxihemoglobina fueron controladas por cooxímetro y estaban elevadas (6,3% y 3,2%, respectivamente). El personal de la farmacia de la UCI revisó extensamente la lista de medicamentos del paciente y no estaba recibiendo ningún agente conocido por inducir metahemoglobinemia. El paciente ya estaba en tratamiento con ácido ascórbico intravenoso y se continuó con la dosis (1500 mg cada 8 horas). Se administraron hidroxocobalamina intravenosa (5 g) y azul de metileno intravenoso (1,5 mg / kg) con una mejora mínima en la Sp o 2. La concentración de carboxihemoglobina se normalizó, pero la concentración de metahemoglobina siguió aumentando con un pico del 15,9% (normal 0% -1%). Se administró otra dosis de azul de metileno intravenoso (1,5 mg / kg). Los consultores de hematología recomendaron la continuación de azul de metileno, así como la transfusión de glóbulos rojos, teniendo en cuenta el intercambio de glóbulos rojos si persistía la hipoxia. Afortunadamente, la Sp o 2 mejoró a> 90% con 2 unidades de concentrado de glóbulos rojos. Los niveles de metahemoglobina disminuyeron al 2% -4% y la hemoglobina aumentó de 7.8 a 10.4 g / dL. Después de un curso prolongado en UCI (29 días), el paciente se recuperó lentamente. Pasó de la terapia de reemplazo renal continua a la hemodiálisis intermitente el día 23 en el hospital. Fue extubado el día 27 y dado de alta a un centro de cuidados intensivos a largo plazo 4 días después. DISCUSIÓN La metahemoglobinemia es una condición poco común caracterizada por niveles elevados de metahemoglobina, que puede conducir a hipoxia y anoxia tisular. 1 La causa más común de metahemoglobinemia adquirida es la exposición a agentes oxidantes. 2 Los fármacos que causan metahemoglobinemia incluyen derivados de nitrato (sal de nitratos, nitroglicerina), derivados de nitrito (nitroprusiato, nitrito de amilo, óxido nítrico), sulfonamidas, dapsona, fenacetina, fenazopiridina y algunos anestésicos locales y tópicos (lidocaína, prilocaína). 3 Los niveles de metahemoglobina pueden estar elevados en pacientes con sepsis debido a la liberación de óxido nítrico, que se convierte en nitrato y posteriormente en metahemoglobina. 5Sin embargo, en ese informe específico, los pacientes no tenían metahemoglobinemia por encima del 2%. Además, los pacientes con enfermedad cardíaca, pulmonar y hematológica subyacente, cirrosis, infección por el virus de la inmunodeficiencia humana e insuficiencia renal en hemodiálisis son más susceptibles a la metahemoglobinemia. 3 La etiología de la metahemoglobinemia, en este caso, permanece desconocida. Varios medicamentos (acetaminofén, hidroxicloroquina, tocilizumab y norepinefrina) podrían haber sido la causa. Sin embargo, el momento de la administración de estos medicamentos no coincide con la aparición de los síntomas (tabla). Su episodio de shock séptico por neumonía por corynebacterium también se había resuelto con la finalización del ciclo de antibióticos. El paciente había estado en terapia de reemplazo renal durante casi 2 semanas antes de su diagnóstico de metahemoglobinemia, lo que hace que la insuficiencia renal sea un culpable poco probable. No tenía antecedentes de anemia de células falciformes, que puede causar metahemoglobinemia. En este caso de metahemoglobinemia, no pudimos identificar la causa, lo que planteó la posibilidad de cambios de hemoglobina relacionados con el coronavirus que pueden haber contribuido. No hay evidencia clínica en la literatura que apoye esta posibilidad. Sin embargo, un reciente estudio no clínico y no biológico de China aclara este punto y explica que algunas de las proteínas del síndrome respiratorio agudo severo coronavirus-2 se unen a la porfirina de la hemoglobina para cambiar su capacidad de unión al oxígeno y disminuir la liberación de oxígeno en los tejidos.4 Las características clínicas de la metahemoglobinemia varían según la concentración de metahemoglobina y son más graves en pacientes con afecciones preexistentes (por ejemplo, anemia, enfermedades respiratorias y cardiovasculares que comprometen la oxigenación de los tejidos). 2 , 3 En una persona sana, las características clínicas son palidez, fatiga, debilidad, taquicardia, taquipnea y cianosis, que pueden ser clínicamente evidentes con metahemoglobina tan baja como 10%. A medida que el porcentaje de metahemoglobinemia se acerca al 20%, el paciente puede experimentar ansiedad, mareos y dolores de cabeza. A concentraciones de metahemoglobina de 30 a 50%, puede haber taquipnea, confusión y pérdida del conocimiento. Si la metahemoglobina se acerca al 50%, los pacientes tienen riesgo de convulsiones, arritmias, acidosis metabólica y coma. 1, 6 Dado que nuestro paciente estaba intubado y sedado, el único indicador clínico fue la hipoxia refractaria a la oxigenoterapia máxima. Las medidas de Pa o 2 por análisis de gases en sangre arterial pueden permanecer notablemente normales y pueden estar falsamente elevadas en la metahemoglobinemia. 7 A medida que la metahemoglobina aumenta del 2% al 30%, la Sp o 2 cae de lo normal (alrededor del 98%) a alrededor del 85%, pero no se produce una caída adicional en la saturación de oxígeno si la metahemoglobina se eleva por encima del 30% -35%. 8 La cooximetría es el único método confiable de medir la concentración de metahemoglobina para confirmar un diagnóstico de metahemoglobinemia. 9La mayoría de los analizadores de gases en sangre modernos tienen un cooxímetro incorporado, que permite examinar la sangre arterial en múltiples longitudes de onda espectrofotométricamente. Todas las especies de hemoglobina tienen espectros de absorbancia característicos. Por tanto, la cooximetría identifica y cuantifica todas las especies de hemoglobina, incluida la metahemoglobina. La cooximetría también calcula la saturación de oxígeno y es un método más confiable para evaluar la saturación de oxígeno en pacientes con metahemoglobina que la oximetría de pulso o el análisis de gases en sangre. 9 El tratamiento de la metahemoglobinemia incluye la eliminación del agente desencadenante y la consideración de un tratamiento con un antídoto. Las recomendaciones incluyen azul de metileno (1,5 mg / kg), ácido ascórbico (1500 mg cada 8 horas) y oxígeno de alto flujo. 10 En casos raros de hipoxia refractaria por metahemoglobinemia, las transfusiones de glóbulos rojos y el intercambio de glóbulos rojos han tenido éxito en algunos informes de casos. 11 En conclusión, los pacientes críticamente enfermos con COVID-19 pueden desarrollar hipoxia refractaria severa por una causa inexplicable de metahemoglobinemia, que puede ser difícil de diagnosticar. Es necesario tener un alto índice de sospecha de metahemoglobinemia en un paciente crítico con COVID-19 con hipoxia persistente y discrepancias entre Sp o 2 , Pa o 2 y Sa o 2 . El mecanismo de la metahemoglobinemia en la enfermedad COVID-19 necesita más investigación, pero demostramos que el manejo exitoso podría requerir transfusiones de glóbulos rojos. DIVULGACIONES Nombre: Hina Faisal, MD, MRCS. Contribución: Este autor es el autor principal y correspondiente que identificó este caso, realizó una revisión extensa de la literatura, obtuvo el consentimiento de un paciente para su publicación, ayudó con la descripción del caso, recopiló información clínica, redactó borradores del artículo y revisó el manuscrito de manera crítica para obtener información valiosa. contenido intelectual. Este autor también es responsable de la comunicación con la revista durante el proceso de envío, revisión por pares y publicación del manuscrito. Nombre: Alexi Bloom, MD. Contribución: Este autor ayudó como coautor en la revisión de la literatura necesaria, ayudó a recopilar información clínica, redactar el borrador del manuscrito y revisarlo. Nombre: A. Osama Gaber, MD, FACS. Contribución: este autor principal ayudó a escribir y editar el borrador original del manuscrito. Este manuscrito fue manejado por: BobbieJean Sweitzer, MD, FACP. REFERENCIAS 1. Wright RO, Lewander WJ, Woolf AD. Metahemoglobinemia: etiología, farmacología y manejo clínico. Ann Emerg Med . 1999; 34 : 646–656 [ PubMed ] [ Google Scholar ] 2. Skold A, Cosco DL, Klein R. Metahemoglobinemia: patogenia, diagnóstico y tratamiento. Sur Med J . 2011; 104 : 757–761 [ PubMed ] [ Google Académico ] 3. Alanazi MQ. Los fármacos pueden inducir metahemoglobinemia. J Hematol Thrombo Dis . 2017; 270 : 1–5 [ Google Académico ] 4. Wenzhong L, Li H. COVID-19: ataca la cadena 1-beta de la hemoglobina y captura la porfirina para inhibir el metabolismo del hemo humano. ChemRxiv . 2020. Preprint. 10.26434 / chemrxiv.11938173.v7 [ CrossRef ] 5. Ohashi K, Yukioka H, Hayashi M, Asada A. Metahemoglobina elevada en pacientes con sepsis. Acta Anaesthesiol Scand . 1998; 42 : 713–716 [ PubMed ] [ Google Académico ] 6. Wilkerson RG. Ponerse el blues en un concierto de rock: un caso de metahemoglobinemia severa. Emerg Med Australas . 2010; 22 : 466–469 [ PubMed ] [ Google Académico ] 7. Haymond S, Cariappa R, Eby CS, Scott MG. Evaluación de laboratorio de oxigenación en metahemoglobinemia. Clin Chem . 2005; 51 : 434–444 [ PubMed ] [ Google Académico ] 8. Watcha MF, Connor MT, Hing AV. Pulsioximetría en metahemoglobinemia. Soy J Dis Child . 1989; 143 : 845–847 [ PubMed ] [ Google Académico ] 9. Brunelle JA, Degtiarov AM, Moran RF, Race LA. Medición simultánea de hemoglobina total y sus derivados en sangre utilizando CO-oxímetros: principios analíticos; su aplicación en la selección de longitudes de onda analíticas y métodos de referencia; una comparación de los resultados de las elecciones realizadas. Scand J Clin Lab Invest Supl . 1996; 224 : 47–69 [ PubMed ] [ Google Scholar ] 10. Rehman HU. Metahemoglobinemia. West J Med . 2001; 175 : 193–196 [ artículo gratuito de PMC ] [ PubMed ] [ Google Scholar ] 11. Pritchett MA, Celestin N, Tilluckdharry N, Hendra K, Lee P. Tratamiento exitoso de la metahemoglobinemia refractaria con exanguinotransfusión de glóbulos rojos. Pecho . 2006; 130 : 294S [ Google Académico ]
El surgimiento de la metahemoglobinemia en medio de la pandemia de COVID -19
Soy J Hematol. 3 de junio de 2020: 10.1002 / ajh.25868. doi: 10.1002 / ajh.25868 [ Publicación electrónica antes de la impresión] PMCID: PMC7276830 PMID: 32413176
Leonard Naymagon , 1 Shana
Berwick , 1 Alaina
Kessler , 1 Guido
Lancman , 1 Umesh
Gidwani , 2 y Kevin
Troy 1 Información del autor Notas del artículo Información sobre derechos de autor y licencia Renuncia de responsabilidad Este artículo ha sido citado por otros artículos en PMC. 1. Al editor: La enfermedad por coronavirus 2019 (COVID-19) se ha asociado con una variedad de hallazgos hematológicos y complicaciones [ 1 ]. Hemos encontrado tres casos de metahemoglobinemia significativa y cinco casos de metahemoglobinemia relativamente leve entre pacientes que estaban siendo tratados por COVID-19 en nuestro sistema de salud durante un período de 4 semanas en abril de 2020. En comparación, solo hubo un caso de metahemoglobinemia adquirida leve de cualquier causa documentada en nuestro sistema de salud durante el año anterior. A continuación, describimos los tres casos de metahemoglobinemia significativa, incluidas sus presentaciones, tratamientos y resultados. Caso 1: Un hombre de 50 años sin antecedentes médicos presentó insuficiencia respiratoria hipóxica aguda (ICAH) debido a COVID-19. Recibió hidroxicloroquina el día de hospitalización (HD) 1 y continuó hasta la HD5. También recibió breves cursos de azitromicina y ceftriaxona. Se deterioró rápidamente, requiriendo intubación y ventilación mecánica en HD2, inicio de vasopresores en HD3 y terapia de reemplazo renal en HD4. Saturación de oxígeno persistentemente baja en la oximetría de pulso, a pesar de la ventilación mecánica con 100% de FIO 2,co-oximetría de sangre inducida. Esto demostró niveles en constante aumento de metaheomoglobina (Met ‐ Hb) que alcanzaron un máximo del 10,6% en HD6. Recibió 1 mg / kg de azul de metileno, sin embargo demostró una respuesta mínima con respecto a la oxigenación y el nivel de Met-Hb, por lo que recibió otro 1 mg / kg en HD7 y 2 mg / kg en HD8. Los niveles de Met ‐ Hb comenzaron a disminuir gradualmente a partir de entonces, aunque no se normalizaron, y el paciente fue tratado con ácido ascórbico 500 mg tres veces al día en HD8 - HD10, con normalización del nivel de Met ‐ Hb por HD11. Posteriormente, el estado clínico del paciente mejoró y, aunque ya no requiere ventilación mecánica ni diálisis, permanece hospitalizado. Caso 2: Un hombre de 52 años con antecedentes de obesidad mórbida y diabetes mellitus no complicada fue ingresado por AHRF en el contexto de una infección por COVID-19. Requirió inicio de ventilación mecánica y vasopresores en HD2, y terapia renal sustitutiva en HD7. Recibió un ciclo de 5 días de hidroxicloroquina en HD2‐6. Otros medicamentos recibidos incluyeron azitromicina, cefepima, vancomicina y apixabán. En HD6, saturación de oxígeno persistentemente baja en la oximetría de pulso a pesar de la ventilación mecánica con 100% de FIO 2impulsó la co-oximetría sanguínea, que demostró un nivel de Met-Hb del 22%. El paciente recibió azul de metileno 1 mg / kg y luego 2 mg / kg, así como ácido ascórbico concurrente, sin embargo, su nivel de Met-Hb aumentó a> 30%. Por lo tanto, recibió intercambio de glóbulos rojos en HD9 con una rápida mejoría en su nivel de Met-Hb (al 2,9%) y su oxigenación. Continuó con ácido ascórbico durante varios días hasta la normalización completa de su nivel de Met-Hb. El paciente permanece gravemente enfermo y, aunque ya no necesita vasopresores, permanece intubado y dependiente de diálisis. Caso 3: Un hombre de 54 años con antecedentes de diabetes mellitus no complicada ingresó por AHRF debido a una infección por COVID-19. Comenzó con azitromicina en HD1 e hidroxicloroquina en HD2. Requirió intubación por empeoramiento de la insuficiencia respiratoria en HD4, sin embargo demostró hipoxia persistente a pesar de la ventilación mecánica con FIO 2 del 100%. Esto provocó la co-oximetría sanguínea que demostró un nivel de Met-Hb del 13,7%. Al mismo tiempo, se observó que tenía evidencia de hemólisis negativa de Coombs. Recibió 1,8 mg / kg de azul de metileno; sin embargo, su Met-Hb aumentó aún más hasta el 18,8% y los estudios de laboratorio indicaron un empeoramiento de la hemólisis y un nuevo diagnóstico de deficiencia de G6PD. El paciente falleció poco después. La metahemoglobinemia se produce cuando el hierro del grupo de las porfirinas del hemo se oxida de la forma ferrosa (Fe 2+ ) a la férrica (Fe 3+ ) [ 2 ]. El hemo férrico se une al oxígeno de manera irreversible, lo que resulta en un desplazamiento a la izquierda de la curva de disociación oxígeno-hemoglobina. La metahemoglobinemia se adquiere con mayor frecuencia, principalmente debido a medicamentos oxidantes. Los agentes antipalúdicos, incluida la cloroquina, se han asociado con la metahemoglobinemia, aunque en raras ocasiones [ 3]. Aunque aparentemente tiene menos potencial oxidante que la cloroquina, es posible que el dramático aumento en el uso de hidroxicloroquina en medio de la pandemia de COVID-19 esté haciendo que esta complicación sea más común. Esto probablemente se ve agravado por el grado de enfermedad crítica entre muchos pacientes con COVID-19, que los somete a un mayor estrés oxidativo, dejándolos más susceptibles a la metahemoglobinemia inducida por medicamentos. Los tres pacientes con metahemoglobinemia significativa discutidos anteriormente recibieron hidroxicloroquina, al igual que los cinco pacientes con elevaciones relativamente leves de Met ‐ Hb (3% - 7%) encontradas durante este período de tiempo. El único otro fármaco utilizado con frecuencia entre esta cohorte de pacientes fue la azitromicina, que no se sabe que sea un agente oxidante. Adicionalmente, todos los pacientes de esta serie (incluidos los tres con elevación significativa de Met-Hb presentados anteriormente y los cinco con elevaciones más leves) ya estaban gravemente enfermos antes del inicio de la hidroxicloroquina y, por lo tanto, probablemente se encontraban bajo estrés oxidativo incluso antes del inicio de cualquier medicación. No está claro si alguna propiedad adicional de COVID-19, además de inducir estrés oxidativo durante la enfermedad grave, podría predisponer a la metahemoglobinemia. Dadas las muchas propiedades atípicas de esta pandemia, esto ciertamente vale la pena considerarlo, sin embargo, aún falta evidencia rigurosa que relacione las dos. además de inducir estrés oxidativo durante una enfermedad grave, podría predisponer a la metahemoglobinemia. Dadas las muchas propiedades atípicas de esta pandemia, esto ciertamente vale la pena considerarlo, sin embargo, aún falta evidencia rigurosa que relacione las dos. además de inducir estrés oxidativo durante una enfermedad grave, podría predisponer a la metahemoglobinemia. Dadas las muchas propiedades atípicas de esta pandemia, esto ciertamente vale la pena considerarlo, sin embargo, aún faltan pruebas rigurosas que relacionen las dos. Rara vez se piensa en el diagnóstico de metahemoglobinemia dada su rareza y, por lo tanto, puede permanecer infradiagnosticado durante la pandemia de COVID-19. La presentación típica consiste en síntomas abruptos de hipoxia tisular después de la exposición a una sustancia oxidante. En particular, como se trata de una afección de mayor avidez de hemo ‐ oxígeno en lugar de hipoxemia, los niveles de oxígeno disuelto en los gases en sangre pueden ser normales a pesar de la evidencia clínica de hipoxia y la disminución de las lecturas en la oximetría de pulso. Por lo tanto, se requiere un alto índice de sospecha y el diagnóstico se realiza con mayor frecuencia mediante la co-oximetría o la prueba de Met-Hb en sangre específica. La gravedad de los síntomas generalmente se correlaciona con el nivel de Met-Hb, aunque los pacientes con compromiso respiratorio concurrente (como los de esta serie) pueden volverse sintomáticos a niveles más bajos [ 4]. El tratamiento consiste en la interrupción del fármaco causante y el uso de agentes reductores como el azul de metileno y / o el ácido ascórbico [ 2 ]. Los casos refractarios de metahemoglobinemia pueden beneficiarse del intercambio de glóbulos rojos (como se demostró en el caso 2). Es importante destacar que el azul de metileno debe evitarse entre los pacientes con deficiencia de G6PD, como se demostró en el caso 3 en el que empeoró la hemólisis negativa de Coombs en un paciente con deficiencia de G6PD. En particular, este paciente tenía alguna evidencia de hemólisis incluso antes de recibir azul de metileno, y no está claro si esto puede haber estado relacionado con la hidroxicloroquina (ya que no estaba tomando otros medicamentos potencialmente oxidantes) o con el COVID-19 en sí (aunque tal complicación no se ha producido ha sido bien descrito hasta la fecha). Los otros pacientes de esta serie no tenían deficiencia de G6PD (ambos fueron evaluados). DECLARACIÓN DE DIVULGACIÓN No se recibió financiación para la preparación de este manuscrito. Los autores declaran no tener ningún conflicto de interés relevante. REFERENCIAS 1. Terpos E, Ntanasis ‐ Stathopoulos I, Elalamy I, et al. Hallazgos hematológicos y complicaciones de COVID ‐ 19 . Soy J Hematol. 2020. 10.1002 / ajh.25829. [ Artículo gratuito de PMC ] [ PubMed ] [ CrossRef ] [ Google Scholar ] 2. Cortazzo JA, Lichtman AD. Metahemoglobinemia: revisión y recomendaciones para su manejo . J Cardiothorac Vasc Anesth. 2014; 28 ( 4 ): 1043‐1047. [ PubMed ] [ Google Académico ] 3. Cohen RJ, Sachs JR, Wicker DJ, Conrad ME. Metahemoglobinemia provocada por quimioprofilaxis de la malaria en Vietnam . N Engl J Med. 1968; 279 ( 21 ): 1127‐1131. [ PubMed ] [ Google Académico ] 4. Mansouri A, Lurie AA. Revisión concisa: metahemoglobinemia . Soy J Hematol. 1993; 42 ( 1 ): 7‐12. [ PubMed ] [ Google Académico ]
Damir Bojadzic , 1 Oscar Alcazar , 1 y Peter Buchwald 1, 2, * Información del autor Notas del artículo Información sobre derechos de autor y licencia Renuncia de responsabilidad Datos asociados Declaración de disponibilidad de datos
Abstracto
Introducción El síndrome respiratorio agudo severo-coronavirus 2 (SARS-CoV-2), un nuevo betacoronavirus y el más reciente de los siete coronavirus (CoV) que se sabe que infectan a los seres humanos, es responsable del COVID-19, que ha sido declarado pandemia por el Organización Mundial de la Salud en marzo de 2020 y continúa extendiéndose por todo el mundo ( Liu et al., 2020 ; Matheson y Lehner, 2020 ; Moore y junio de 2020). Si bien cuatro CoV (HCoV 229E, OC43, NL63 y HKU1) son responsables de aproximadamente un tercio de los casos de resfriado común en humanos, tres han causado epidemias recientes asociadas con una mortalidad considerable: SARS-CoV-1 (2002-2003, causando ∼ 10% de mortalidad), MERS-CoV (coronavirus causante del síndrome respiratorio de Oriente Medio; 2012, que causa ~ 35% de mortalidad), y ahora SARS-CoV-2 (2019-2020), que parece ser menos letal pero más transmisible ( Guy et al. ., 2020 ). El SARS-CoV-2 es el agente más infeccioso en un siglo ( Tiwari et al., 2020) y ya ha causado infecciones del orden de decenas de millones y muertes que probablemente sean del orden de millones en todo el mundo. Según las primeras estimaciones actuales, alrededor del 3% de las personas infectadas necesitan hospitalización y el 0,5% muere, un rango que depende en gran medida de la edad y aumenta del 0,001% en <20 años al 8,3% en los> 80 años ( Salje et al. , 2020 ). Por consiguiente, existe un interés considerable en posibles tratamientos preventivos o terapéuticos. Hay varios objetivos posibles en el ciclo de vida del coronavirus para las intervenciones terapéuticas, que incluyen la unión y entrada, el descortezamiento, la replicación del ARNg, la traducción en el retículo endoplásmico (RE) y el Golgi, el ensamblaje y la liberación del virión ( Guy et al., 2020). La unión y entrada de virus son particularmente prometedores, ya que son los primeros pasos en el ciclo de replicación y tienen lugar en un sitio extracelular relativamente accesible; por lo tanto, se han explorado con fines de intervención para varios virus ( Melby y Westby, 2009 ). Los CoV usan su proteína de pico (S) glicosilada para unirse a sus receptores de superficie celular afines e iniciar la fusión de la membrana y la entrada del virus. Tanto para el SARS-CoV como para el SARS-CoV-2, la proteína S media la entrada en las células al unirse a la enzima convertidora de angiotensina 2 (ACE2) a través de su dominio de unión al receptor (RBD) seguido de la activación proteolítica por proteasas humanas ( Lan et al. , 2020 ; Matheson y Lehner, 2020 ; Shang et al., 2020 ; Sivaraman et al., 2020). El bloqueo de esta interacción proteína-proteína (PPI) RBD-ACE2 puede alterar la eficacia de la infección; por ejemplo, se demostró que la proteína RBD del SARS-CoV-2 bloquea la entrada del pseudovirus del SARS-CoV-2 mediada por la proteína S en las células diana que expresan el receptor ACE2 ( Tai et al., 2020 ). Los anticuerpos pueden ser inhibidores de PPI bastante eficaces, y son altamente específicos de la diana y relativamente estables in vivo . Sin embargo, no pueden alcanzar los objetivos intracelulares y, como todas las demás terapias con proteínas, se ven obstaculizadas por problemas como baja solubilidad, propensión a la inmunogenicidad, semividas de eliminación prolongadas, falta de biodisponibilidad oral, heterogeneidad del producto y posibles problemas de estabilidad de fabricación y almacenamiento. Dado que son proteínas extrañas, provocan una fuerte respuesta inmune en ciertos pacientes (Suntharalingam y col., 2006 ; Wadman, 2006 ; Leader et al., 2008 ), e incluso si están aprobados para uso clínico, tienden a tener más problemas de seguridad posteriores a la comercialización que los medicamentos de molécula pequeña ( Downing et al., 2017 ). Los inhibidores de molécula pequeña (SMI) son más difíciles de identificar para los IBP, pero ahora está bien establecido que pueden ser efectivos contra ciertos IBP y pueden ofrecer alternativas útiles. En la actualidad, hay más de 40 IBP dirigidos por SMI que se encuentran en desarrollo preclínico, y dos de estos SMI están aprobados para uso clínico (venetoclax y lifitegrast) ( Arkin y Wells, 2004 ; Milroy et al., 2014 ; Scott et al., 2016 ; Bojadzic y Buchwald, 2018 ). Debido a nuestro interés en el espacio químico de los colorantes orgánicos para identificar posibles SMI para los IBP ( Margolles-Clark et al., 2009a ; Margolles-Clark et al., 2009b ; Ganesan et al., 2011 ; Song et al., 2014 ; Chen et al., 2017 ; Bojadzic y Buchwald, 2018 ; Bojadzic et al., 2018), iniciamos un cribado de dichos compuestos por su capacidad para inhibir la interacción entre la proteína de pico del SARS-CoV-2 y su receptor afín ACE2, que es el primer paso crítico que inicia la unión viral y la entrada de este CoV. Como parte de esto, encontramos que el azul de metileno, un compuesto de fenotiazina tricíclico aprobado para el tratamiento de la metahemoglobinemia adquirida y algunos otros usos ( Clifton y Leikin, 2003 ; Schirmer et al., 2011 ; Bistas y Sanghavi, 2020), inhibe esta interacción y hemos confirmado que lo hace de manera dependiente de la concentración. Esto puede contribuir a la actividad antiviral de este fármaco a base de colorante de bajo costo y ampliamente disponible contra el SARS-CoV-2, lo que lo hace potencialmente útil en la prevención y el tratamiento de COVID-19, especialmente en países no industrializados. Materiales y métodos Ensayos de unión El azul de metileno y otros compuestos de prueba usados aquí se obtuvieron de Sigma-Aldrich (St. Louis, MO, Estados Unidos) y se usaron como tales. Las purezas (y números de catálogo) fueron las siguientes: azul de metileno> 95% (M4159), cloroquina> 98,5% (C6628), eritrosina B 90% (198269), siramesina> 98% (SML0976), amarillo ocaso FCF 90% (465224) ) y azul tripán al 60% (302643). La suramina (> 99%; cat. Nº 1472) era de Tocris Bioscience (Biotechne, Minneapolis, MN, Estados Unidos). Las proteínas ACE2-Fc y SARS-CoV-2 S1 o RBD con etiqueta de His utilizadas en los ensayos de unión se obtuvieron de Sino Biological (Wayne, PA, Estados Unidos); catálogo no. 10108-H05H, 40591-V08H y 40592-V08H). Los ensayos de inhibición de la unión se realizaron en un formato sin células de 96 pocillos similar al descrito anteriormente ( Margolles-Clark et al., 2009b ;Ganesan y col., 2011 ; Song et al., 2014 ; Chen y col., 2017). Brevemente, se recubrieron placas de microtitulación (Nunc F Maxisorp, 96 pocillos; Thermo Fisher Scientific, Waltham, MA, Estados Unidos) durante la noche a 4 ° C con 100 μL / pocillo de receptor ACE2 conjugado con Fc diluido en PBS pH 7,2. A esto le siguió el bloqueo con 200 μL / pocillo de SuperBlock (PBS) (Thermo Fisher Scientific) durante 1 ha temperatura ambiente. Luego, las placas se lavaron dos veces con solución de lavado (PBS pH 7,4, Tween-20 al 0,05%) y se secaron con golpecitos antes de la adición del ligando marcado (SARS-CoV-2 S1 o RBD) y los compuestos de prueba se diluyeron en tampón de unión (100 mM HEPES, pH 7,2) para dar un volumen total de 100 μL / pocillo. Después de 1 h de incubación, se realizaron tres lavados y se realizó una incubación de 1 h más con conjugado anti-His HRP (BioLegend; San Diego, CA, Estados Unidos; catálogo n. ° 652504) diluido (1: 2500) en SuperBlock (PBS). utilizado para detectar el ligando marcado con His unido. Las placas se lavaron cuatro veces antes de la adición de 100 μL / pocillo de sustrato HRP TMB (3,3 ', 5,5'-tetrametilbencidina) y se mantuvieron en la oscuridad hasta por 15 min. La reacción se detuvo usando 20 μL de 1 MH2 SO 4 , y se leyó el valor de absorbancia a 450 nm. Las concentraciones en placa del receptor ACE2 fueron de 1,0 μg / ml para SARS-CoV-2 RBD y 2,0 μg / ml para SARS-CoV-2 S1. Las concentraciones del ligando usado en los ensayos inhibidores fueron 0,5 µg / ml para RBD y 1,0 µg / ml para S1. Estos valores se seleccionaron después de pruebas preliminares para optimizar la respuesta (es decir, para producir una señal suficientemente alta en condiciones cercanas a la mitad de la respuesta máxima, EC 50 ). Las evaluaciones de unión para CD40-CD40L y TNF-R1-TNF-α se realizaron como se describió anteriormente ( Bojadzic et al., 2018 ). Se utilizaron soluciones madre de compuestos a 10 mM en DMSO. Ensayo de pseudovirus SARS-CoV-2 Se utilizó el ensayo de Montana Molecular (Bozeman, MT, Estados Unidos; nº de catálogo C1100R y C1100G) según las instrucciones del fabricante con modificaciones menores. Brevemente, las células HEK293T (ATCC, Manassas, VA, Estados Unidos;. Catálogo CRL-1573) fueron sembradas en placas de 96 pocillos a una densidad de 5 x 10 4 células por pocillo en 100! L de medio completo (DMEM suplementado con 10% suero bovino fetal). Una mezcla de transducción que contiene ACE2 BacMam virus Red-Reporter (1,8 × 10 8 VG / ml) y se añadió butirato de sodio 2 mM preparado en medio completo (50! L por pocillo) y se incubaron durante 24 h a 37 ° C y 5% de CO 2. Se retiró el medio, se lavaron una vez con PBS, y se sustituye con 100! L de medio fresco que contiene azul de metileno a concentraciones seleccionadas, pre-incubando durante 30 min a 37 ° C y 5% de CO 2 . Se añadió una mezcla de transducción que contenía pseudovirus Pseudo SARS-CoV-2 Green-Reporter (3,3 × 10 8 VG / ml) y butirato de sodio 2 mM preparado en medio completo (50 µL por pocillo) y se incubó durante 48 ha 37 ° C y 5% CO 2 . El medio se retiró, se lavó una vez con PBS, se reemplazó con 150 µl de medio fresco y las células se incubaron durante 48 horas adicionales a 37 ° C y 5% de CO2 .. La fluorescencia celular se detectó usando un microscopio EVOS FL (Life Technologies, Carlsbad, CA, Estados Unidos) y se cuantificó en ImageJ (Institutos Nacionales de Salud de Estados Unidos, Bethesda, MD, Estados Unidos) ( Schneider et al., 2012 ) usando el Herramienta Analizar partículas después de establecer el umbral para los colores correspondientes. Ajuste de estadísticas y datos Todos los ensayos de inhibición de unión y de células se probaron al menos por duplicado por placa, y los ensayos se realizaron como al menos dos experimentos independientes. Como antes ( Ganesan et al., 2011 ; Song et al., 2014 ; Chen et al., 2017 ), los datos de unión se convirtieron en porcentaje de inhibición y se ajustaron con modelos estándar de inhibidor de registro frente a respuesta normalizada ( Buchwald, 2020 ) utilizando regresión en GraphPad Prism (GraphPad, La Jolla, CA, Estados Unidos) para establecer la mitad de las concentraciones máximas (mediana) efectivas o inhibidoras (EC 50 , IC 50 ). Resultados Como parte de nuestro trabajo para identificar SMI para la co-señalización de IBP que son esenciales para la activación y el control de las células inmunes, descubrimos que el espacio químico de los colorantes orgánicos, que es particularmente rico en quelantes de proteínas fuertes, puede ofrecer un punto de partida útil. . En consecuencia, parecía lógico explorarlo en busca de posibles inhibidores de la proteína SRAG-CoV-2 S-ACE2 PPI, que es un primer paso esencial para la entrada viral de este nuevo coronavirus altamente infeccioso. Como primer paso, exploramos la viabilidad de establecer ensayos de detección utilizando un formato de 96 pocillos de tipo ELISA sin células similar a los utilizados en nuestros trabajos anteriores con receptores conjugados con Fc recubiertos en la placa y FLAG- o His- ligandos marcados en la solución ( Margolles-Clark et al., 2009b ; Ganesan et al., 2011 ;Song et al., 2014 ; Chen et al., 2017 ). Para establecer las condiciones del ensayo, primero realizamos evaluaciones de concentración-respuesta utilizando un formato de este tipo con ACE2-Fc y SARS-CoV-2 S1 o RBD con etiqueta His, e indicaron que ambos enlaces siguen patrones sigmoides clásicos con un enlace ligeramente más fuerte para RBD que S1 (Figura 1). El ajuste de los datos proporcionó concentraciones efectivas medianas (CE 50 s) y, por lo tanto, estimaciones de la constante de afinidad de unión ( K d ) de 5 y 13 nM, respectivamente (127 y 1,008 ng / ml), de acuerdo con las especificaciones del fabricante y los valores publicados. que también se encuentran en el rango nanomolar bajo (4–90 nM), generalmente basado en estudios de resonancia de plasmón de superficie (SPR) ( Sivaraman et al., 2020 ).
Curvas de concentración-respuesta para la unión de la proteína de pico S1 y RBD del SARS-CoV-2 a ACE2 en nuestro formato de ensayo basado en ELISA. Datos obtenidos con ACE2 conjugado con Fc recubierto en la placa y S1 marcado con His o RBD agregado en cantidades crecientes como se muestra con la cantidad unida detectada usando un conjugado anti-His-HRP (media ± DE para dos experimentos por duplicado). En consecuencia, podemos usar este formato para la detección inhibitoria, y decidimos usar hACE2 con SARS-CoV-2 RBD-His, ya que mostró una unión más fuerte. De hecho, esta configuración de ensayo es muy similar a una que se demostró recientemente que funciona como una prueba de neutralización del virus sustituto del SARS-CoV-2 específica y sensible basada en el bloqueo mediado por anticuerpos de este mismo PPI (CoV-S-ACE2) ( Tan et al. ., 2020 ). Con esta configuración en nuestras manos, realizamos una selección preliminar de tintes orgánicos representativos de nuestra biblioteca interna más algunos compuestos que son o se han considerado de posible interés en la inhibición de SAR-CoV-2 mediante diferentes mecanismos de acción, por ejemplo, cloroquina, siramesina y suramina ( Colson et al., 2020 ; Gordon et al., 2020 ; McKee et al., 2020 ;Salgado-Benvindo et al., 2020 ; Xiu et al., 2020 ). El cribado a 5 µM indicó que la mayoría no tiene actividad y, por lo tanto, es poco probable que interfiera con la unión de la proteína S-ACE2 necesaria para la unión viral. Sin embargo, algunos mostraron actividad; los de compuestos seleccionados de interés se muestran enFigura 2junto con las correspondientes estructuras químicas. Se incluyó como posible control positivo la eritrosina B (ErB, FD y C rojo n. ° 3), un colorante alimentario aprobado por la FDA, ya que previamente hemos demostrado que es un inhibidor promiscuo de IBP junto con otros colorantes de xanteno ( Ganesan et al., 2011 ), y de hecho mostró una fuerte inhibición aquí. De particular interés, el azul de metileno (MeBlu), que tiene una larga historia de diversas aplicaciones médicas ( Clifton y Leikin, 2003 ; Schirmer et al., 2011 ; Bistas y Sanghavi, 2020 ), también mostró una actividad inhibidora prometedora.
Efecto inhibidor de compuestos seleccionados sobre la unión de SARS-CoV-2 RBD a hACE2 en nuestro ensayo de detección. Los valores porcentuales de inhibición obtenidos a una concentración de 5 µM se muestran normalizados al control (100%). La eritrosina B, un SMI promiscuo conocido de los IBP ( Ganesan et al., 2011 ) y el amarillo ocaso FCF (FD y C amarillo n. ° 6), un colorante alimentario que probablemente sea inactivo, se incluyeron como controles positivos y negativos, respectivamente. Las estructuras químicas se muestran con fines comparativos. Por lo tanto, para confirmar su actividad, realizamos evaluaciones detalladas de concentración-respuesta según lo recomendado por las pautas experimentales en farmacología y biología experimental ( Curtis et al., 2018 ; Michel et al., 2020 ). Como se muestra enfigura 3, Esto confirmó que MeBlu de hecho inhibe en forma dependiente de la concentración con una CI estimado 50 de 3,0? M (IC del 95%: 2.5 a 3.6? M), mientras que la cloroquina y la suramina no mostraron actividad inhibitoria en este ensayo. Se incluyó la cloroquina, un fármaco antiparasitario e inmunosupresor utilizado principalmente para prevenir y tratar la malaria, ya que tiene actividad antiviral potencial contra el SARS-CoV-2 (sujeto a controversias) ( Colson et al., 2020 ). La suramina, un fármaco antiparasitario aprobado para el tratamiento profiláctico de la enfermedad del sueño africana (tripanosomiasis) y la ceguera de los ríos (oncocercosis), se incorporó porque se afirmaba que inhibía la infección por SARS-CoV-2 en cultivos celulares, muy probablemente al prevenir la unión o la entrada del virus. virus ( Salgado-Benvindo et al., 2020) (así como porque descubrimos anteriormente que inhibía el PPI CD40-CD40L ( Margolles-Clark et al., 2009a )). ErB también inhibió con un IC 50 de 0,4? M, lo que es coherente con nuestra observación anterior de la inhibición de PPI promiscua por este compuesto con una actividad posiblemente ligeramente mayor que el encontrado para otros IBP probado antes (1-20? M) ( Ganesan et al., 2011 ). El amarillo ocaso FCF (amarillo FD y C n. ° 6), un colorante azoico y un colorante alimentario aprobado por la FDA incluidos como posible control negativo, de hecho no mostró actividad inhibidora.
Inhibición dependiente de la concentración de la unión de SARS-CoV-2 RBD a ACE2 por compuestos seleccionados. Curvas de concentración-respuesta obtenidas en un ensayo de tipo ELISA con ACE2 conjugado con Fc recubierto en la placa (1 μg / ml) y RBD marcado con His (0,5 μg / ml) agregado y cantidad unida en presencia de concentraciones crecientes de compuestos de prueba detectados . Como antes, la eritrosina B (ErB) y el amarillo ocaso FCF (SY (FD & C # 6)) se incluyeron como controles positivos y negativos, respectivamente. Los datos (media ± DE para dos experimentos por duplicado) se normalizaron y ajustaron con curvas de inhibición estándar; obtenidos IC 50 valores se muestran a la derecha. A continuación, también pudimos demostrar que MeBlu inhibe la entrada de un pseudovirus que lleva la proteína de pico SARS-CoV-2 S en células HEK293T que expresan ACE2. Este ensayo de pseudovirus basado en BacMam permite la cuantificación de la entrada viral, ya que el pseudovirus expresa una proteína fluorescente verde brillante que se dirige al núcleo de las células huésped que expresan el indicador de fluorescencia roja y ACE2, mientras que puede manejarse con un nivel de bioseguridad de contención 1 porque no lo hacen. replicar en células humanas. La entrada de pseudovirus está indicada por la expresión de fluorescencia verde en el núcleo; si la entrada está bloqueada, el núcleo celular permanece oscuro. MeBlu mostró una inhibición dependiente de la concentración claro con un estimado de IC 50 de 3,5? M (IC del 95%: 1.6 a 7.4? M) (Figura 4). En este ensayo que involucró una exposición de 48 h, MeBlu mostró signos de citotoxicidad a concentraciones más altas (45 μM) que afectan la viabilidad incluso si no afectan la expresión general de ACE2 (barras rojas,Figura 4). Dado que el IC 50 obtenido para MeBlu aquí (3 M) está dentro de la gama de sus niveles circulantes siguientes dosis clínica normal (por ejemplo, concentración en sangre máxima de 19! M después de 500 mg po con una vida media de eliminación de ~ 14 h ( Walter- Sack et al., 2009 ) o niveles mínimos de 6-7 μM en voluntarios humanos sanos después de dosis orales de 207 mg / día (69 mg, tres veces al día) ( Baddeley et al., 2015 ), este efecto inhibidor sobre la unión viral puede contribuir a la posible actividad antiviral de MeBlu contra el SARS-CoV-2 y posiblemente otros CoV que se unen a ACE2 como el SARS-CoV y el α-coronavirus HCoV NL63.
Inhibición dependiente de la concentración de la entrada del pseudovirus del SARS-CoV-2 en las células que expresan ACE2 por el azul de metileno. (A) Imágenes de un experimento de dilución en serie que muestra que MeBlu inhibe la entrada de un pseudovirus basado en BacMam que lleva la proteína SARS-CoV-2 S (más indicadores de proteína fluorescente verde) en las células huésped que expresan ACE2 (más fluorescencia roja) (HEK293T) . La cantidad de rojo presente (fila superior) es proporcional al número de células que expresan ACE2; la cantidad de verde (fila inferior) es proporcional al número de células infectadas, ya que la fluorescencia verde se expresa solo en las células infectadas con pseudovirus. (B)Correspondiente cuantificación para pseudovirus (verde) y la expresión de ACE2 (rojo) que se muestra en escala semilogarítmica y equipado con una curva sigmoidal clásico que indica un IC 50 de 3,5? M (datos promedio de dos experimentos independientes). Discusión Los resultados aquí confirman una vez más la utilidad de nuestra estrategia de confiar en el espacio químico de los colorantes orgánicos, que se sabe que contienen fuertes ligantes de proteínas, como plataforma de partida para identificar los andamios de SMI para la inhibición de PPI. Con esta estrategia, hemos logrado un progreso considerable en la focalización de interacciones de co-señalización, ya que identificamos los primeros SMI para CD40-CD40L ( Margolles-Clark et al., 2009b ) y OX40-OX40L PPI ( Song et al., 2014 ) como así como los primeros SMI promiscuos de IBP ( Ganesan et al., 2011 ). Los tintes orgánicos contienen estructuras privilegiadas para la unión de proteínas ( Che et al., 2006 ; Fletcher y Hamilton, 2006 ; Hershberger et al., 2007) y, contrariamente a las bibliotecas habituales de fármacos, cuyo espacio químico no se corresponde bien con el de los inhibidores de IBP prometedores ( Neugebauer et al., 2007 ; Reynès et al., 2010 ; Sperandio et al., 2010 ), son un buen punto de partida para identificar SMI de PPI. Sin embargo, la mayoría de los colorantes no son adecuados para el desarrollo terapéutico debido a su fuerte color y, en el caso de los colorantes azoicos, a su rápida degradación metabólica ( Levine, 1991 ; Feng et al., 2012 ); por lo tanto, se necesita más química médica para optimizar su potencial clínico ( Chen et al., 2017 ). Más importante aún, nuestros resultados indican que MeBlu, un colorante orgánico de uso clínico para algunas aplicaciones terapéuticas en el mundo desarrollado ( Clifton y Leikin, 2003 ; Schirmer et al., 2011 ; Bistas y Sanghavi, 2020 ) y con potencial adicional para ciertos desarrollos aplicaciones mundiales como la malaria ( Dicko et al., 2018), puede inhibir la unión viral y la entrada de SARS-CoV-2 al bloquear el PPI de su proteína de pico con ACE2 en la célula huésped. MeBlu es un colorante de fenotiazina tricíclico aprobado por la FDA para uso clínico para el tratamiento de la metahemoglobinemia y también se usa para otras aplicaciones como la prevención de infecciones del tracto urinario en pacientes ancianos; neurotoxicidad inducida por ifosfamida en pacientes con cáncer; síndrome vasopléjico, un tipo de choque distributivo que se produce durante los procedimientos coronarios; y visualización intraoperatoria de nervios, tejidos nerviosos y glándulas endocrinas ( Schirmer et al., 2011 ; Bistas y Sanghavi, 2020). MeBlu está incluido en la Lista de Medicamentos Esenciales de la OMS y, de hecho, fue el primer fármaco totalmente sintético utilizado en medicina, ya que se utilizó para tratar la malaria desde 1891 ( Schirmer et al., 2011 ). Esta utilización se extendió a lo largo de la Segunda Guerra Mundial hasta que fue reemplazada por cloroquina; aunque, por la orina azul que podía provocar, el MeBlu no era del agrado de los soldados (“Incluso en el retrete vemos, hacemos pipí, azul marino”) ( Schirmer et al., 2011 ). También sirvió como el compuesto principal para el desarrollo de clorpromazina y antidepresivos tricíclicos ( Schirmer et al., 2011 ). Además, existe un interés resurgente en su aplicación antipalúdica ( Dicko et al., 2018), y tiene potencial para el tratamiento de trastornos neurodegenerativos como la enfermedad de Alzheimer (EA), debido a su supuesta acción inhibidora sobre la agregación de la proteína tau ( Schirmer et al., 2011 ). Cabe destacar que MeBlu también fue parte del primer método desarrollado para la inactivación de patógenos en plasma, donde se ha utilizado desde 1991 para inactivar virus en combinación con la luz ( Lozano et al., 2013 ). MeBlu se intercala dentro de las hebras de ácido nucleico y la aplicación de luz provoca su excitación generando oxígeno singlete altamente reactivo que oxida la guanosina y rompe las hebras nucleicas ( Lozano et al., 2013 ). Por lo tanto, en presencia de luz, MeBlu tiene una actividad virucida de amplio espectro y se usa para inactivar virus en productos sanguíneos antes de las transfusiones. En particular, también hay evidencia reciente de una posible actividad antiviral in vitro para MeBlu incluso en ausencia de activación inducida por UV. Por ejemplo, un grupo encontró que MeBlu mostró actividad virucida a concentraciones micromolares bajas cuando se incubó con células Vero E6 y SARS-CoV-2 durante 20 h en la oscuridad ( Cagno et al., 2020 ). Otro grupo también encontró no fotoactivada MeBlu para inhibir la infección por SARS-CoV-2 replicación en Vero E6 in vitro con una CI 50 de 0,3 ± 0,03? M a una multiplicidad de infección (MOI) de 0,25 ( Gendrot et al., 2020). La capacidad de MeBlu para inhibir el PPI del SARS-CoV-2-S-ACE2 podría ser un mecanismo de acción que contribuya a dicha actividad, especialmente porque también demostramos que MeBlu inhibe la entrada del pseudovirus del SARS-CoV-2 en las células que expresan ACE2 con IC 50 micromolar bajo (Figura 4). Si esta actividad inhibidora de PPI de MeBlu se retiene a niveles similares in vivo a los encontrados aquí (IC 50 ≈ 3 μM), está dentro de un rango que puede obtenerse en sangre después de dosis típicas (por ejemplo, 200 mg / día) como lo indica estudios farmacocinéticos en humanos. Por ejemplo, en un estudio, la concentración sanguínea máxima de MeBlu fue de 19 μM después de 500 mg por vía oral, y la vida media de eliminación también fue más que adecuada, de alrededor de 14 h ( Walter-Sack et al., 2009 ). En otro estudio, se obtuvieron niveles mínimos de 6-7 μM luego de dosis orales diarias totales de 207 mg / día (administradas como 69 mg, po, tid) ( Baddeley et al., 2015). Por lo tanto, la administración oral podría proporcionar concentraciones adecuadas (p. Ej.,> 7 μM) y las aplicaciones inhaladas, que se han explorado en países menos desarrollados para algunos tratamientos respiratorios ( Golwalkar, 2020 ), podrían ser aún más ventajosas. MeBlu es generalmente seguro, pero muestra toxicidad dependiente de la dosis con náuseas, vómitos, hemólisis y otros efectos secundarios no deseados que comienzan a ocurrir a dosis> 7 mg / kg (es decir,> 500 mg) ( Clifton y Leikin, 2003 ; Bistas y Sanghavi, 2020 ). También está contraindicado en ciertas poblaciones, por ejemplo, en quienes toman inhibidores de la recaptación de serotonina y en personas con deficiencia hereditaria de glucosa-6-fosfato deshidrogenasa (deficiencia de G6PD) ( Schirmer et al., 2011 ; Bistas y Sanghavi, 2020).). Sin embargo, debe tenerse en cuenta que MeBlu también inhibió los PPI CD40-CD40L y TNF-R1-TNFα en nuestros ensayos con potencia micromolar baja a media (datos no mostrados); por tanto, es posible que MeBlu sea un inhibidor de PPI algo promiscuo que limite su utilidad. Su estructura de fenotiazina de tres anillos se parece un poco a la estructura de xanteno de tres anillos de la eritrosina B (Figura 2), que hemos demostrado anteriormente que actúa como inhibidor de PPI promiscuo junto con algunos otros colorantes de xanteno análogos estructurales como la rosa de Bengala y la floxina ( Ganesan et al., 2011 ). MeBlu ciertamente muestra polifarmacología y actúa sobre una multitud de objetivos ( Schirmer et al., 2011 ); Sin embargo, muchos de estos pueden tener efectos beneficiosos adicionales en pacientes con COVID-19 ( Scigliano y Scigliano, 2020 ). Su principal mecanismo de acción es reducir la forma férrica oxidada de la hemoglobina (Fe 3+ ) cuando se encuentra en un estado de metahemoglobinemia, que une el oxígeno de manera irreversible, a la forma ferrosa (Fe 2+ ) ( Bistas y Sanghavi, 2020). Esto aumenta la capacidad de unión de oxígeno de la hemoglobina y, por lo tanto, el suministro de oxígeno a los tejidos, un beneficio importante para los pacientes con COVID-19. Los pacientes con COVID-19 a menudo exhiben niveles bajos de oxígeno, típicamente incompatibles con la vida sin disnea, un fenómeno denominado hipoxemia silenciosa (o hipoxia feliz en los medios públicos) ( Tobin et al., 2020 ). Posiblemente relevante para esto, se encontró que MeBlu mejora la hipoxemia y la circulación hiperdinámica en pacientes con cirrosis hepática y síndrome hepatopulmonar severo ( Schenk et al., 2000 ). MeBlu se está utilizando para el tratamiento de la neumonía y otras dolencias respiratorias en países menos desarrollados con cierto éxito ( Golwalkar, 2020 ). Además, se demostró recientemente que MeBlu bloquea el PPI PD-1-SHP2, que está aguas abajo del PPI de co-señalización PD-1-PD-L1, con una potencia micromolar baja y lo suficientemente eficaz como para contrarrestar la actividad supresora de PD-1 en linfocitos T citotóxicos y restauran su citotoxicidad, activación, proliferación y actividad secretora de citocinas ( Fan et al., 2020 ). Este mecanismo de acción dirigido a esta vía de co-señalización (PD-1) podría contribuir a restaurar la homeostasis y la función de las células T desde el estado de agotamiento ( Barber et al., 2006 ; Vardhana y Wolchok, 2020), que es de interés para mejorar el aclaramiento viral y frenar la respuesta inmune inflamatoria y la tormenta de citocinas asociada durante respuestas antivirales como las que causan la alta mortalidad de los pacientes con COVID-19 ( Di Cosimo et al., 2020 ; Liu et al., 2020 ; Ye et al., 2020 ). En cuanto a las aplicaciones clínicas, una indicación prometedora proviene de un informe de una cohorte de 2.500 pacientes franceses tratados con MeBlu como parte de su atención oncológica, ninguno de los cuales desarrolló una enfermedad similar a la influenza durante las epidemias de COVID-19 ( Henry et al., 2020 ) . MeBlu también se ha explorado en un ensayo clínico de fase uno ( NCT04370288 ) para el tratamiento de pacientes con COVID-19 en estado crítico en Irán como parte de un cóctel complementario de última opción terapéutica de tres fármacos (MeBlu 1 mg / kg, vitamina C 1500 mg / kg y N-acetilcisteína 2000 mg / kg) basado en la hipótesis de que esta combinación podría reequilibrar el NO, la metahemoglobina y el estrés oxidativo. Cuatro de los cinco pacientes respondieron bien al tratamiento ( Alamdari et al., 2020 ). En conclusión, el cribado de nuestra biblioteca basada en colorantes orgánicos identificó a MeBlu como un inhibidor micromolar bajo de la interacción entre la proteína espiga del SARS-CoV-2 y su receptor afín ACE2, un PPI que es el primer paso crítico que inicia la entrada viral de este virus. coronavirus. Si bien MeBlu muestra una fuerte polifarmacología y podría ser un inhibidor de PPI algo promiscuo, su capacidad para inhibir este PPI podría contribuir a la actividad antiviral de MeBlu contra el SARS-CoV-2 incluso en ausencia de luz, lo que hace que este fármaco económico y ampliamente disponible sea potencialmente útil en la prevención y el tratamiento de COVID-19 como medicación oral o inhalada. Declaración de disponibilidad de datos Los datos en bruto que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas. Contribuciones de autor DB realizó la mayoría de los experimentos, OA realizó el ensayo de pseudovirus. PB originó y diseñó el proyecto, proporcionó orientación para el estudio y redactó el borrador del manuscrito. Todos los autores contribuyeron a la redacción y lectura del manuscrito final. Conflicto de intereses Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses. Expresiones de gratitud Se agradece el apoyo financiero de la Diabetes Research Institute Foundation ( www.diabetesresearch.org ). Abreviaturas ACE2, enzima convertidora de angiotensina 2; CoV, coronavirus; MeBlu, azul de metileno; PPI: interacción proteína-proteína; SARS, síndrome respiratorio agudo severo; SMI, inhibidor de molécula pequeña. Referencias
Cloruro de metiltioninio (azul metileno): actualización sobre la toxicidad del sistema nervioso central (SNC) UK-UNITED KINGDON Se deben evitar dosis intravenosas altas de cloruro de metiltioninio (azul metileno) para pacientes tratados con antidepresivos serotonérgicos (por ejemplo, ISRS, clomipramina y venlafaxina). De: Agencia Reguladora de Medicamentos y Productos Sanitarios publicado: 11 de diciembre de 2014 Área terapéutica: Endocrinología, diabetología y metabolismo, Hematología Fecha del artículo: abril de 2009 Cloruro de metiltioninio (anteriormente llamado azul metileno) está aprobado para el manejo de la metaemoglobinaemia inducida por drogas en adultos. También se utiliza para otros fines, pero estos usos no están cubiertos por la licencia de producto. Sobre la base de 27 informes de toxicidad del SNC asociados con el metiltioninium, la edición de enero de 2008 de la actualización de la seguridad de los medicamentos aconsejó cómo se podía minimizar el riesgo. El resumen de las características del producto para cloruro de metiltioninio ahora se ha actualizado para mencionar la posibilidad de toxicidad del SNC en pacientes tratados con fármacos serotonérgicos como antidepresivos selectivos de recaptación de serotonina (ISRS), clomipramina y venlafaxina. Las características de la toxicidad incluyen confusión, desorientación, agitación, afasia expresiva, alteración del tono muscular en las extremidades, hipoxia, síntomas oculares y nivel deprimido de conciencia. Todos los casos revisados describieron la toxicidad del SNC después del uso de metiltioninium como agente visualizador en cirugía paratiroidea o tiroidea. Desde la revisión, han salido a la luz otros casos de toxicidad del SNC en asociación con el metiltioninium. Cinco de los nuevos casos se referían a cirugía paratiroidea (2 casos notificados sobre tarjetas amarillas y 3 documentados en la literatura [nota 1] [nota 2] [nota 3]). Sin embargo, otro nuevo caso de toxicidad del SNC implicó el uso de metiltioninium para el manejo de la hipotensión incontrolable durante la cirugía cardíaca [nota 4]. En todos los casos nuevos, los pacientes estaban siendo tratados con un antidepresivo o clomipramina SSRI, y las características de la toxicidad eran similares a las reportadas anteriormente. En cuatro casos, los reporteros calificaron la reacción como síndrome de la serotonina. Estos informes adicionales, que elevan el número total de casos a 33, refuerzan la posibilidad de que la toxicidad del SNC resulte de una interacción entre un fármaco serotonérgico y el metiltioninium. Al informarnos de una sospecha de reacción adversa al medicamento en una tarjeta amarilla, es útil si puede dar información sobre el resultado del paciente; esto nos ayuda a priorizar la información. Al igual que con la visualización en procedimientos quirúrgicos, el manejo de la hipotensión intratable no es una indicación aprobada para el cloruro de metiltioninio. En vista de estos nuevos informes, hemos reforzado el asesoramiento a los profesionales sanitarios. El asesoramiento para profesionales de la salud incluye: · cloruro de metiltioninio por vía intravenosa está aprobado sólo para la metaemoglobinaemia inducida por fármacos en adultos a una dosis de 1-2 mg/kg · el uso fuera de etiqueta de metiltioninium (incluido el uso en la localización paratiroidea o su uso a dosis superiores a la dosis autorizada) debe evaluarse cuidadosamente en vista del potencial de toxicidad del SNC · cloruro de metiltioninio intravenoso debe evitarse en pacientes que hayan sido tratados recientemente con antidepresivos serotonérgicos, incluidos ISRS, clomipramina y venlafaxina · si no se puede evitar el uso de cloruro intravenoso de metiltioninium, se debe utilizar la dosis más baja posible y observar estrechamente al paciente los efectos del SNC durante un tiempo de hasta 4 horas después de la administración · si las características de la toxicidad del SNC se desarrollan después del uso de metiltioninium, el paciente debe ser monitoreado de cerca y recibir atención de apoyo Artículo cita: actualización de seguridad de drogas abril de 2009, vol 2 número 9: 3. REFERENCIAS:
|
|||||||||||||||||||||||||||||||||||||||||||
|